实验室有三瓶失去标签的无色溶液:氯化钾、氢氧化钙和稀硫酸,可用一种常见酸碱指示剂X 或Na2CO3一次鉴别它们。根据有关操作及所加试剂填空。
⑴ 现象:溶液显紫色;另取该溶液滴入Na2CO3溶液中,无明显现象。试推断试剂X为 。
现象:溶液显紫色;另取该溶液滴入Na2CO3溶液中,无明显现象。试推断试剂X为 。
⑵ 现象:溶液显蓝色;另取该溶液滴入Na2CO3溶液中的现象为____________;有关反应的离子方程式为 __________。
现象:溶液显蓝色;另取该溶液滴入Na2CO3溶液中的现象为____________;有关反应的离子方程式为 __________。
⑶ 现象:有气泡产生,有关反应的离子方程式为___________________;另取该溶液滴入试剂X,则溶液显_____________
现象:有气泡产生,有关反应的离子方程式为___________________;另取该溶液滴入试剂X,则溶液显_____________
(一)下列各组物质的分离或提纯,应选用下述方法的哪一种?(填序号)
A分液 B过滤 C萃取 D蒸馏 E结晶
从碘水中提取碘 ;分离植物油和水 ;
(二)实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案: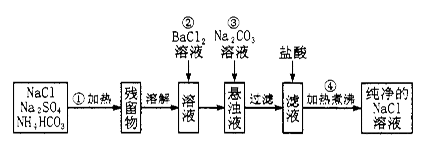
如果此方案正确,那么:
(1)操作②是否可改为加硝酸钡溶液?为什么? 。
(2)操作③的目的是_____________,为什么不先过滤后加碳酸钠溶液?理由是_________________
(三)某水样中要检验出H+ 、SO42-、Cl- 离子,三位学生进行了如下不同的实验:
甲同学:取少量溶液先滴加石蕊溶液,再加入稍过量BaCl2溶液,充分振荡后静置,取上层清液加入AgNO3溶液。
乙同学:取少量溶液先加入稍过量Ba(NO3)2溶液,充分振荡后静置,取上层清液加入AgNO3溶液,再加入少量NaHCO3粉末。
(1)评价二位同学实验的合理性。甲_________ 乙___________(填“合理”或“不合理”)。如不合理,请说明原因____________________(如合理,此空不填)
(2)甲同学所加的BaCl2溶液应该是稍过量的, 判断该试剂过量的方法是: 。
已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
(1)该“84消毒液”的物质的量浓度约为 (保留两位有效数字)
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液(必须用到容量瓶)。下列说法正确的是 (填序号)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器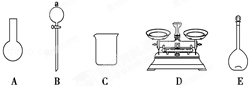
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0g
(3)若实验遇下列情况,则所配溶液的物质的量浓度是:A、偏高B、偏低C、不变(用符号回答)
Ⅰ.定容时俯视刻度线 ;
Ⅱ.定容时水多用胶头滴管吸出 。
(4) “84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84g•cm﹣3)的浓硫酸配制2 000mL 2.3mol•L﹣1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为 mol•L﹣1;
②需用浓硫酸的体积为 mL。
有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3、K2SO4中的一种或几种,现按下列步骤进行实验。
(1)将该粉末溶于水得无色溶液和白色沉淀。
(2)在滤出的沉淀中加入过量稀硝酸,有部分沉淀溶解,同时产生无色气体。
(3)取滤液做焰色反应,火焰呈黄色,透过蓝色钴玻璃观察没有明显现象。
由上述现象推断:
该混合物中一定含有 ;一定不含有 ;可能含有 ,如要检验其是否存在,应如何操作(写明操作步骤及实验结论) 。
某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。限选试剂:1.00 mol·L-1 HNO3、2.00 mol·L-1HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴。
(1)他们能完成哪些因素对速率影响的探究?____________________。
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
| 实验编号 |
T/℃ |
大理石规格 |
HNO3浓度/mol·L-1 |
| ① |
常温 |
细颗粒 |
2.00 |
| ② |
细颗粒 |
1.00 |
|
| ③ |
35℃ |
2.00 |
|
| ④ |
35℃ |
2.00 |
(3)整个实验中应控制的不变量是硝酸溶液体积和 。
(4)该实验小组用如图实验装置进行实验。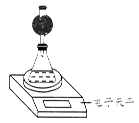
①除电子天平、干燥管、锥形瓶、药匙、胶塞等仪器外,必需的实验仪器还有___ _____。
②干燥管中应放置的试剂是________。
A.碱石灰B.无水CaCl2
C.P2O5固体D.浓硫酸
③若撤除干燥管装置,所测速率________(填“偏大”、“偏小”或“不变”)。
实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4+ +6HCHO =3H++6H2O+(CH2)6N4H+ [滴定时,1 mol (CH2)6N4H+与 l mol H+相当,然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I称取样品1.500 g。
步骤II将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1—2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤III 填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积_______(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察____________
(A)滴定管内液面的变化 (B)锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由_________色变成_________色。
(2)滴定结果如下表所示: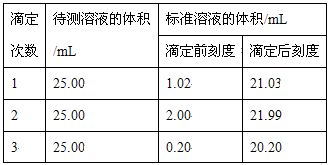
若NaOH标准溶液的浓度为0.1010 mol·L-1,则该样品中氮的质量分数为___________。