某研究所对含硫酸亚铁和硫酸铜的工业废料进行相关的研究。实验过程如下:
回答下列问题:
(1)滤渣的成分为____和____,(填化学式) 操作①的名称为____ 。
(2)上图溶液B中所发生反应的离子方程式为 __________ 。
(3)实验要求向溶液B中通入过量的空气,证明通入空气过量的方法是 。
(4)操作③第一步需要的仪器除了酒精灯、铁架台外,还需要___ _和___ _ 。
(5)某同学利用下面装置制备氢气并利用氢气还原某金属氧化物,根据要求回答问题。
请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是A→_____→_____→_____→D(除D装置外,其它装置不能重复使用),最后D装置中所加药品为___________,其作用是___________。
碘溶于碘化钾溶液中形成I3—,并建立如下平衡:I3— I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
实验原理:
为了测定平衡时的c(I3—) ,可用过量的碘与碘化钾溶液一起摇动,达平衡后取上层清液用标准的Na2S2O3滴定:2 Na2S2O3 + I2 =" 2NaI" + Na2S4O6。
由于溶液中存在I3— I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
实验内容:
1.用一只干燥的100 mL 碘量瓶和一只250 mL碘量瓶,分别标上1、2号,用量筒取80 mL 0.0100 mol.L-1 KI于1号瓶,取200 mL 蒸馏水于2号瓶,并分别加入0.5 g过量的碘。
2.将两只碘量瓶塞好塞子,振荡30分钟,静置。
3.分别取上层清液20 mL用浓度为c mol/L标准Na2S2O3溶液进行滴定。1号瓶消耗V1 mL Na2S2O3溶液,2号瓶消耗V2 mL Na2S2O3溶液。
4.带入数据计算c(I3—)
试回答下列问题
(1)标准Na2S2O3溶液应装入(填“酸式滴定管”或“碱式滴定管”),原因是。
(2)碘量瓶在震荡静置时要塞紧塞子,可能的原因是
(3)滴定时向待测液中加入的指示剂是,到达滴定终点时的现象为。
(4)用c 、V1和V2表示c(I3—)为mol·L-1。
(5)若在测定1号瓶时,取上层清液时不小心吸入了少量的I2固体,则测定的c(I3—)(填“偏大”、“偏小”或“不变”)
某化学兴趣小组以工业碳酸钙(含少量Al2O3、Fe2O3、SiO2等杂质)生产二水合氯化钙晶体(CaCl2·2H2O)的操作流程为: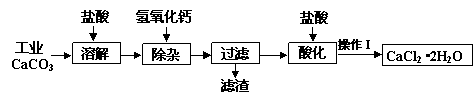
(1)CaCO3与盐酸反应的离子方程式。
(2)加入氢氧化钙溶液调节溶液的pH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为,若用氢氧化钠溶液除杂则产品中可能混有的物质为。
(3)酸化时加盐酸将溶液的pH调节到4.0左右,其主要目的是。
(4)操作Ⅰ中应包括①蒸发浓缩②冷却结晶③过滤④⑤等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取7.350 g样品配成200.0 mL溶液,与205.0 mL 0.5000 mol/LAgNO3溶液恰好完全反应。
①样品中CaCl2·2H2O的质量分数为。
②若计算出结果有明显偏差,你认为在操作Ⅰ的五个步骤中由引起的(填序号),理由是。
金属钠与水的反应是中学化学中的一个重要反应。在高中化学教材的几次改版中该实验曾出现过几种不同的演示方法,分别如下图中甲、乙、丙所示: 
(1)现按图甲所示的方法,在室温时,向盛有Ca(HCO3)2溶液的水槽中,加入一小块金属钠。下列现象描述正确的是_________(填字母)。
A.钠浮在液面上,并四处游动,最后消失
B.钠熔化成一个光亮的小球
C.反应开始后,溶液由无色变红色
D.恢复到室温时,烧杯底部有固体物质析出
(2)请补充并完成甲实验中从试剂瓶中取出钠到向水槽中投入钠的有关操作:用镊子从试剂瓶中取出一小块钠→__________→用镊子夹取金属钠投入到盛有Ca(HCO3)2溶液的水槽中。
(3)按图乙所示方法来收集产生的气体,需将钠包好,再放入水中。取相同质量的钠按下列几种情况收集产生的气体在相同条件下体积最大的是。
A.用铝箔包住钠 B.用锡箔包住钠 C.直接将钠投入的水中
(4)用装满水的矿泉水瓶按图丙方法进行实验,(用手挤压矿泉水瓶共排出水的体积为112 mL)塞紧带有钠的塞子,反应结束后,干瘪的带塞矿泉水瓶恰好恢复成原状,假设瓶内、瓶外均属于标准状况,则所用金属钠的质量是多少克?(写出计算过程)
某化学实验小组为了验证SO2和Cl2的漂白性,设计了如下图所示的实验装置。请回答下列问题:
(1)他们制备SO2和Cl2所依据的原理分别是:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑、MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,则上图A、E装置中用来制Cl2的装置是
MnCl2+Cl2↑+2H2O,则上图A、E装置中用来制Cl2的装置是
(填序号),反应中盐酸所表现的性质是;
(2)反应开始后,发现B、D试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的溶液加热,B试管中的现象是;
(3)装置C的作用是;
(4)NaOH(足量)溶液分别与两种气体反应的离子方程式是、;
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1∶1混合,再与水反应可生成两种常见酸,因而失去漂白作用。该反应的化学方程式为。
滴定实验是化学学科中重要的定量实验。
请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液,下列操作造成测定结果偏高的是(填选项字母)
A.滴定终点读数时,俯视滴定管刻度,其他操作正确。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
(2)氧化还原滴定——取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
| 滴定次数 |
待测液体积 (mL) |
标准KMnO4溶液体积(mL) |
|
| 滴定前读数 |
滴定后读数 |
||
| 第一次 |
25.00 |
0.50 |
20.40 |
| 第二次 |
25.00 |
3.00 |
23.00 |
| 第三次 |
25.00 |
4.00 |
24.10 |
①滴定时,KMnO4溶液应装在(填“酸”或“碱”)式滴定管中,滴定终点时滴定现象是
②该草酸溶液的物质的量浓度为_____________。
(3)沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是(填选项字母)。
| 难溶物 |
AgCl |
AgBr |
AgCN |
Ag2CrO4 |
AgSCN |
| 颜色 |
白 |
浅黄 |
白 |
砖红 |
白 |
| Ksp |
1.77×10-10 |
5.35×10-13 |
1.21×10-16 |
1.12×10-12 |
1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4