碘溶于碘化钾溶液中形成I3—,并建立如下平衡:I3— I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
实验原理:
为了测定平衡时的c(I3—) ,可用过量的碘与碘化钾溶液一起摇动,达平衡后取上层清液用标准的Na2S2O3滴定:2 Na2S2O3 + I2 =" 2NaI" + Na2S4O6。
由于溶液中存在I3— I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
实验内容:
1.用一只干燥的100 mL 碘量瓶和一只250 mL碘量瓶,分别标上1、2号,用量筒取80 mL 0.0100 mol.L-1 KI于1号瓶,取200 mL 蒸馏水于2号瓶,并分别加入0.5 g过量的碘。
2.将两只碘量瓶塞好塞子,振荡30分钟,静置。
3.分别取上层清液20 mL用浓度为c mol/L标准Na2S2O3溶液进行滴定。1号瓶消耗V1 mL Na2S2O3溶液,2号瓶消耗V2 mL Na2S2O3溶液。
4.带入数据计算c(I3—)
试回答下列问题
(1)标准Na2S2O3溶液应装入 (填“酸式滴定管”或“碱式滴定管”),原因是 。
(2)碘量瓶在震荡静置时要塞紧塞子,可能的原因是
(3)滴定时向待测液中加入的指示剂是 ,到达滴定终点时的现象为 。
(4)用c 、V1和V2表示c(I3—)为 mol·L-1。
(5)若在测定1号瓶时,取上层清液时不小心吸入了少量的I2固体,则测定的c(I3—) (填“偏大”、“偏小”或“不变”)
甲乙两人分别用不同的方法配制100ml 3.6mol/L的稀硫酸。
(1)甲:量取20 ml 18 mol/L浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 ml 容量瓶中,用少量的水将 烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
实验所用的玻璃仪器除烧杯、胶头滴管和容量瓶外,还有;
(2)乙:用100 ml 量筒量取20 ml 浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 ml 刻度线,再搅拌均匀。请指出乙同学的错误之处
①,
②。
用下列仪器的编号回答问题
①容量瓶②蒸馏烧瓶③分液漏斗④量筒⑤烧杯
⑴加热时必须垫石棉网的有,
⑵使用时必须检查是否漏水的有。
某学生做浓硫酸性质的实验:
在一支试 管中放入一块很小的铜片,再加入2mL浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃管口处缠放一团蘸有Na2CO3溶液的棉花。加热试管,观察现象.
管中放入一块很小的铜片,再加入2mL浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃管口处缠放一团蘸有Na2CO3溶液的棉花。加热试管,观察现象.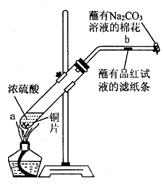
回答下列问题:
(1)写出试管中发生反应的化学方程式。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为 ,待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为。
,待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为。
(3)蘸有Na2CO3溶液的棉花团作用是。
(4)硫酸型酸雨的形成过程可用下列反应中的来表示。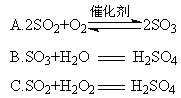
理论上,SO2能发生类似CO2与澄清石灰水作用的反应,但在通常实验中,将SO2通入澄清石灰水却没有看到类似CO2那样先浑浊后澄清的现象。针对这一问题,研究性学习小组开展了探究性实验。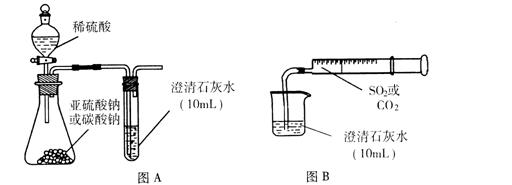
I.用图A所示的装置来分别做CO2、SO2与澄清石灰水的反应实验,结果通人CO2可看到先浑浊后澄清的现象,但通入SO2没看到浑浊现象。
Ⅱ.用图B的装置,将气体收集在注射器里,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,无论CO2还是SO2都能看到“先变浑再澄清”的现象。当以相同速率分别通人CO2或SO2,通入SO2产生现象明显比通入CO2产生现象快。
回答下列问题:
(1)通过上述I、Ⅱ实验,可以确定,将足量SO2缓慢通人澄清石灰水,依次发生的反应有:(用离子方程式表示);。
(2)实验I中,通人SO2不能出现浑浊的原因可能是:。
(3)实验Ⅱ中,同速率分别通入CO2或SO2,SO2产生现象比CO2快的相关因素有。
①SO2在水中溶解度比CO2大。
②相同状态下,SO2的密度比CO2的密度大。
③亚硫酸酸性比碳酸强,在同温度、同体积的溶液中,l mol亚硫酸电离产生的H+离子浓度大于l mol碳酸电离产生的H+离子浓度。
④SO2有毒和刺激性气味, CO2无毒和无刺激性气味。
CO2无毒和无刺激性气味。
⑤相同条件下,1 mol SO2与足量石灰水反应生成CaSO3的速率大于1 mol CO2与足量石灰水反应生成CaCO3的速率。
⑥相同条件下,1 molCaSO3被1mol SO2(形成的H+离子)溶解形成可溶性Ca(HSO3)2
的速率大于1molCaCO3被1molCO2(形成的H+离子)溶解形成可溶性Ca(HCO3)2的速率。
下图是实验室制取Cl2并以Cl2为原料进行特定反应的实验: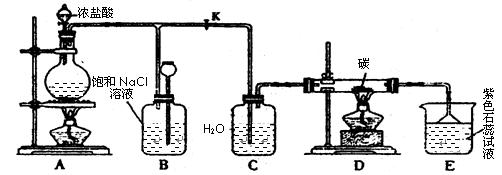
(1)A为氯气发生装置,写出反应的化学方程式________________________。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl,写出D装置中反应的化学方程式_____;装置C的作用是。
(3)E处石蕊试液的现象是_______________;其原因是__________________。
(4)若将E处溶液改为石灰水,反应过程的现象是_____________________________。
A.有白色沉淀生成
B.无白色沉淀生成
C.先生成白色沉淀,然后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此处B中的现象是________________,B的作用是________________。