【化学——选修2:化学与技术】硫铁矿烧渣(主要成分为 Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下:
已知几种盐的溶解度随温度变化的曲线如图所示:
回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是______________。
(2)煅烧 FeCO3生成产品 I的化学反应方程式为 _______。实验室进行煅烧操作所需仪器除了酒精喷灯、泥三角、三脚架、玻璃棒外,还有__________。
(3)产品Ⅱ的化学式为 _______________,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是:__________________。
(4)检验产品 II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液______________。
某研究性学习小组查阅资料得知:漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(C1O)2+CaCl2+H2SO4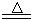 2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。
2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。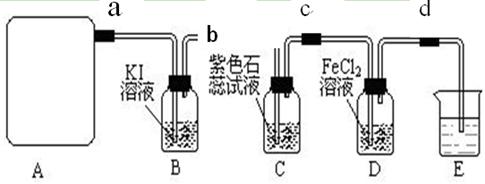
试回答下列问题:
(1)每生成1 mol Cl2,上述化学反应中转移的电子个数为______ (NA表示阿伏加德罗常数)。
(2)该实验中A处可选用装置__________ _____(填写甲.乙.丙或丁)。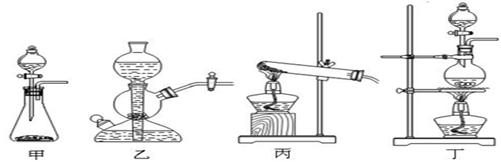
(3)检查A装置的气密性的方法是用弹簧夹夹住处(填a.b.c或d)橡皮管,向分液漏斗中加水并打开活塞,当加到一定量时,停止加水,静止观察,当观察到分液漏斗中时,表明该装置不漏气 。
(4)装置B中发生反应的离子方程式为_____________________。
(5)装置C中的现象为____________________________________。
(6)装置E中的试剂是______________(任填一种合适试剂的名称),
其作用是______________________________
(7)请帮助该学习小组同学设计一个实验,证明装置D中有FeCl3生成(请简述实验 步骤)
步骤)
___________________________________________________________
实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题:
(1)写出烧瓶中发生反应的化学方程式,并标出电子转移的方向和数目
。
(2)B处盛有饱和食盐水(或水),其作用是。
(3)C处盛放的试剂__________(填名称),其作用是。
(4)E处盛有_______(填名称),发生反应的离子方程式为。
(5)实验结束时,应先熄灭__________处酒精灯。
现有铝片、铝粉、镁条、氧化铝、氧化铁、氯化亚铁、盐酸、氯酸钾及其它必用实验用品和仪器,根据现有药品,请你设计2种简单的实验方案证明铝、铁金属单质的还原性强弱(用化学方程式表示)。
方案一:;
方案二:。
中学实验常用如图所示装置制取少量溴苯。在烧瓶a中装的试剂是苯、溴和铁粉。请填写下列空白。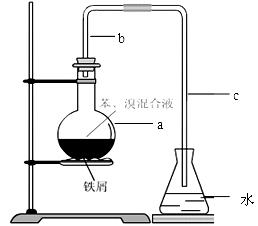
⑴导管b的作用有两个:一是导气,二是兼起的作用;
⑵a中反应的化学方程式为;
⑶该实验得到的是粗苯,为了除去其中的溴,要用到的一种常用除杂操作方法是,提纯溴苯的具体步骤有:
①蒸馏;②水洗;③用干燥剂干燥;④10%NaOH溶液洗;⑤水洗。
正确的操作顺序为()
| A.①②③④⑤ | B.②④⑤③① | C.④②③①⑤ | D.②④①⑤③ |
⑷为证明苯和溴发生的是取代反应而不是加成反应,可向水中加入;但该实验不够严密,为此必须在导管a、b之间加上一盛有的洗气瓶,目的是。
MgSO4·7H2O医药上用作泻剂。工业上用氯碱工业中的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。主要工艺如下: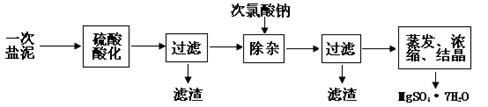
(1)用硫酸调整溶液pH到1~2,硫酸的作用是。 (2)加次氯酸钠溶液至pH=5~6并加热煮沸约5~10分钟,滤渣中主要含MnO2和另两种沉淀,另两种沉淀是(写化学式)。其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为:。
(2)加次氯酸钠溶液至pH=5~6并加热煮沸约5~10分钟,滤渣中主要含MnO2和另两种沉淀,另两种沉淀是(写化学式)。其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为:。
(3)若除杂后过滤,发现滤液发黄,需采取的措施是。
(4)过滤后晶体常用丙酮代替蒸馏水洗涤的目的是。
(5)晶体中结晶水含量的测定:准确称取0.20g MgSO4·7H2O样品,放入已干燥至恒重的瓷坩埚,置于马弗炉中,在200℃脱水1小时。为准确确定脱水后的质量,还需要经过的操作有:冷却(干燥器中)至室温→。
(6)硫酸根离子质量分数的测定:准确称取自制的样品0.50g,用200mL水溶液,加入2mol·L-1HCl溶液5mL,将溶液加热至沸,在不断搅拌下逐滴加入5~6mL0.5mol·L-1BaCl2溶液,充分沉淀后,得沉淀0.466g,则样品中w(SO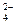 )=。
)=。