已知①2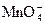 +10Cl-+16H+====2Mn2++5Cl2↑+8H2O ②2Fe3++2I-====2Fe2++I2 ③2Fe2++Cl2====2Fe3++2Cl-。某溶液中含有Cl-和I-,为了氧化I-而不使Cl-被氧化,可选用的氧化剂是
+10Cl-+16H+====2Mn2++5Cl2↑+8H2O ②2Fe3++2I-====2Fe2++I2 ③2Fe2++Cl2====2Fe3++2Cl-。某溶液中含有Cl-和I-,为了氧化I-而不使Cl-被氧化,可选用的氧化剂是
| A.FeCl2 |
| B.浓盐酸 |
| C.KMnO4 |
| D.FeCl3 |
下列叙述不正确的是()
| A.NH3易液化,液氨常用作制冷剂 |
| B.浓HNO3和活泼金属反应时主要得到NO2 |
| C.稀HNO3和活泼金属反应时主要得到氢气 |
| D.铵盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处 |
等物质的量的混合后,缓慢加入BaCl2溶液,再滴入品红试液,发生的现象是()
| A.无沉淀生成,溶液显红色 | B.无沉淀生成,溶液显无色 |
| C.有沉淀生成,溶液显无色 | D.有沉淀生成,溶液显红色 |
下列反应属于氮的固定的是()
| A.空气在雷电作用下所产生NO | B.NO和O2生成NO2 |
| C.铜与浓硝酸反应产生NO2 | D.NH4Cl与Ca(OH)2反应生成NH3 |
将15mLNO和15mLNO2的混合气体,通入倒置水槽充满水的试管中,最后在试管中能收集的气体体积是()
| A.20mL | B.15mL | C.10mL | D.5mL |
区别二氧化硫和二氧化碳气体的最佳方法是()
| A.通入澄清的石灰水 | B.用湿润的蓝色石蕊试纸 |
| C.用品红溶液 | D.根据有无毒性 |