某学习小组用如右图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。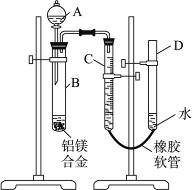
(1)A中试剂为__________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是____________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂;⑤检查气密性。上述操作的顺序是__________(填序号);记录C的液面位置时,除视线平视外,还应__________。
(4)B中发生反应的化学方程式为____________________。
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为__________。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得的质量分数将__________(填“偏大”“偏小”或“不受影响”)。
硫酸亚锡(SnSO4)、四氯化锡(SnCl4)常用于印染和电镀工业。
(1)某研究小组设计SnSO4制备路线如下:
已知:酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化;SnCl2极易水解。
①SnCl2酸溶后加入Sn粉的作用是 。
②步骤Ⅱ中用到的玻璃仪器除烧杯外还有 ;步骤Ⅳ中需要洗涤固体SnO中含有的杂质,检验SnO中的Cl-是否洗涤干净的操作为 。
③步骤Ⅴ涉及到的操作有:a.过滤 b.洗涤 c.蒸发浓缩 d.冷却结晶 e.低温干燥,则其正确的操作顺序为 。
(2)实验室拟用以下装置,用熔融的金属锡与干燥纯净的氯气制取无水SnCl4(SnCl4熔点-33℃,沸点114.1℃,遇潮湿空气极易水解),此反应过程放出大量的热。
①装置C中应加入试剂为___________;仪器E的名称为____________________。
②反应开始生成SnCl4时,可以先熄灭___(填字母序号)处的酒精灯,理由是________。
③该实验装置设计尚存在缺陷,改进的方法是(包括仪器、试剂及连接位置等)______________。
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。工业设计生产NaClO2的主要流程如下: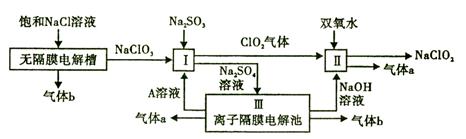
(1)气体b的化学式是 ,若装置III中生成49gA,则生成A的电极反应共 (填“失去”或“得到”)电子物质的量为 。
(2)I中反应的离子方程式是 。
(3)通电电解前,检验III中阴离子的方法和步骤是 。
(4)为防止II中制备的NaClO2被还原成NaCl,应选合适的还原剂,除双氧水外,还可以选择的还原剂
是 (填字母编号)。
a.Na2O2 b.FeCl2 c.Na2S
(5)常温时,HClO2的电离平衡常数Ka=1.07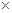 10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中
10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中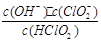 = 。
= 。
(6)气体a、b与氢氧化钠溶液可构成燃料电池,用该电池电解200 mL 0.5 mol·L-1的CuSO4溶液,生成铜3.2 g,此时所得溶液中离子浓度由大到小的顺序是 。
【化学与技术】氯碱工业是最基本的化学工业之一,它的产品应用广泛。请回答下列问题:
(1)氯碱工业是利用电解食盐水生产 为基础的工业体系。
(2)电解前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,加入下列试剂的顺序合理的是 (填下列各项中序号)。
a、碳酸钠、氢氧化钠、氯化钡 b、碳酸钠、氯化钡、氢氧化钠
c、氢氧化钠、碳酸钠、氯化钡 d、氯化钡、氢氧化钠、碳酸钠
(3)“盐泥”是电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
| 成分 |
NaCl |
Mg(OH)2 |
CaCO3 |
BaSO4 |
其他不溶物 |
| 质量分数(%) |
15~20 |
15~20 |
5~10 |
30~40 |
10~15 |
利用盐泥生产MgSO4·7H2O晶体的工艺流程如下图所示。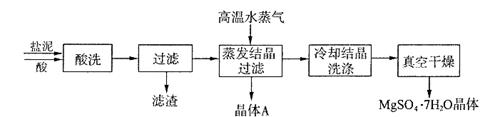
回答下列问题:
①酸洗过程中加入的酸为 ,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4。其中碳酸钙可以转化为硫酸钙的原因是 。
②过滤所得滤渣的主要成分为 。
③根据图分析,蒸发结晶过滤所得晶体A主要成分为 。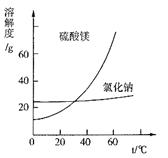
④真空干燥MgSO4·7H2O晶体的原因是 。
某矿样含有大量的CuS及少量其它不溶于酸的杂质。实验室中以该矿样为原料制备CuCl2·2H2O晶体,流程如下: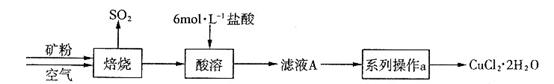
(1)在实验室中,欲用37%(密度为1.19 g·mL-1)的盐酸配制500 mL 6 mol·L-1的盐酸,需要的仪器除量筒、烧杯、玻璃棒外,还有 、 。
(2)①若在实验室中完成系列操作a。则下列实验操作中,不需要的是 (填下列各项中序号)。
②CuCl2溶液中存在如下平衡:Cu(H2O)42+(蓝色)+4Cl-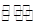 CuCl42-(黄色)+4H2O。
CuCl42-(黄色)+4H2O。
欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中,还需要的是 (填下列各项中序号)。
a.FeCl3固体 b.CuCl2固体 c.蒸馏水
(3)某化学小组欲在实验室中研究CuS焙烧的反应过程,查阅资料得知在空气条件下焙烧CuS时,固体质量变化曲线及SO2生成曲线如下图所示。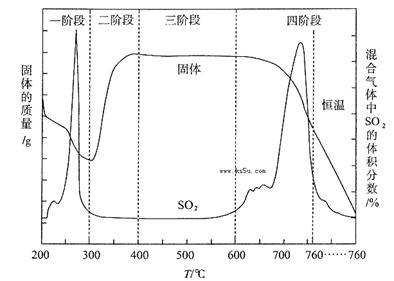
①CuS矿样在焙烧过程中,有Cu2S、CuO·CuSO4、CuSO4、CuO生成,转化顺序为: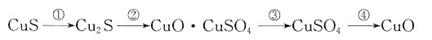
第①步转化主要在200~300oC范围内进行,该步转化的化学方程式为 。
②300~400oC范围内,固体质量明显增加的原因是 ,上图所示过程中,CuSO4固体能稳定存在的阶段是 (填下列各项中序号)。
a.一阶段b、二阶段c、三阶段 d、四阶段
③该化学小组设计如下装置模拟CuS矿样在氧气中焙烧第四阶段的过程,并验证所得气体为SO2和O2的混合物。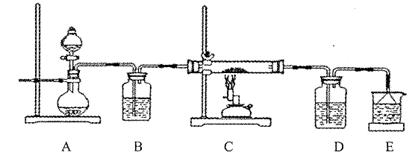
a.装置组装完成后,应立即进行的一项操作是 。
b.当D装置中产生白色沉淀时,便能说明第四阶段所得气体为SO2和O2的混合物。你认为装置D中原来盛有的溶液为 溶液。
c.若原CuS矿样的质量为l0.0 g,在实验过程中,保持温度在760oC左右持续加热,待矿样充分反应后,石英玻璃管内所得固体的质量为8.0 g,则原矿样中CuS的质量分数为 。
MnO2和Zn是制造干电池的重要原料,工业上用软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)联合生产MnO2和Zn的工艺流程如下图所示:
(1)操作I的名称是___ __,判断固体单质A是否洗涤干净的方法是 。
(2)稀硫酸浸泡时反应的离子方程式为____________________;该反应中若消耗8.7g氧化剂,共转移__________mo1电子。浸泡时反应速率较慢,下列措施不能提高浸泡时反应速率的是________(填代号)。
a.将矿石粉碎
b.提高浸泡温度
c.使用98%的浓硫酸浸泡
d.改变软锰矿与闪锌矿的比例
(3)由硫酸锰溶液可得到固体碳酸锰,然后在空气中煅烧碳酸锰制备MnO2。已知: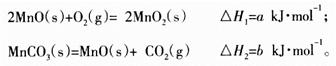
写出碳酸锰在空气中煅烧生成MnO2的热化学方程式_________________________。
(4)用惰性电极电解硫酸酸化的硫酸锰溶液制备MnO2的装置如下图所示: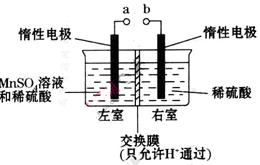
①b应与直流电源的_________(填“正”或“负”)极相连。
②电解过程中氢离子的作用是______________和_____________;a电极方程式为________________。