根据右图,下列热化学方程式书写正确的是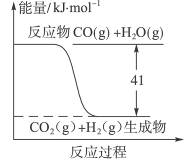
| A.CO+H2O====CO2+H2 ΔH=-41 kJ·mol-1 |
| B.CO(g)+H2O(g)====CO2(g)+H2(g) ΔH=41 kJ·mol-1 |
| C.CO2(g)+H2(g)====CO(g)+H2O(g) ΔH=+ 41 kJ·mol-1 |
| D.CO2(g)+H2(g)====CO(g)+H2O(g) ΔH=-41 kJ·mol-1 |
电解饱和食盐水,当阴极附近有0.4molOH-生成时,阳极生成
| A.0.2mol H2 | B.0.2mol Cl2 | C.0.4mol H2 | D.0.4mol Cl2 |
用石墨做电极电解足量CuSO4溶液。通电一段时间后,欲使用电解液恢复到初始状态,可向溶液中加入适量的
| A.CuSO4 | B.CuO | C.H2O | D.CuSO4·5H2O |
已知在1×105Pa,298K条件下,2mol氢气完全燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
| A.2H2(g)+O2(g)=2H2O(g) △H=+484kJ·mol-1 |
| B.2H2(g)+O2(g)=2H2O(l) △H=-484kJ·mol-1 |
C.H2(g)+ O2(g)=2H2O(g) △H=+242kJ·mol-1 O2(g)=2H2O(g) △H=+242kJ·mol-1 |
D.H2O(g)= H2(g)+ O2 (g) △H=+242kJ·mol-1 O2 (g) △H=+242kJ·mol-1 |
已知反应X+Y= M+N为放热反应,下列说法正确的
| A.X的能量一定高于M |
| B.X和Y的总能量一定高于M和N的总能量 |
| C.Y的能量一定高于N |
| D.因该反应为放热反应,故不必加热就可发生 |
下列过程中ΔH小于零的是
| A.氯酸钾分解制氧气 |
| B.氯化铵受热分解 |
| C.氢气还原氧化铜 |
| D.实验室用锌和稀硫酸反应制氢气 |