如下图所示装置中:

a是盛有标准状况下的空气(氧气占1/5)和10mL 1.2mol/L硝酸的250 mL烧瓶;b是未充气(实验开始前内部没有气体)放有0.384g铜粉的气球;c是夹紧了的弹簧夹;d中盛有足量的过氧化钠;e是充有二氧化碳的针筒。整套装置已经过气密性检查合格。
(1)将气球中的铜粉小心倒入烧杯中,充分反应后发现铜粉有余(设产生的气体不溶解于溶液中),则可观察到的现象是 。
(2)欲提高铜与硝酸反应的速率可采用多种不同的措施。
①若用加入化学试剂法,下列试剂中可以选用的是
| A.蒸馏水 | B.无水醋酸钠 |
| C.石墨 | D.少量硝酸银溶液 |
②若用升温法,请在图中画出完整的示意图。
③将烧瓶不断振荡发现气球逐渐缩小,反应的化学方程式是 ,
此时气球是全在烧瓶外还是一部分进入烧瓶?
④打开弹簧夹,将二氧化碳反推入干燥管内继续振荡,使气体与气体、溶液充分接触,欲使所有的铜粉全溶解,至少需要推入二氧化碳 mL.
⑤将上述全过程用一个总的化学方程式表示: 。
某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。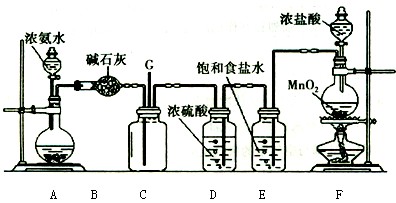
请回答下列问题:
(1)装置F中发生反应的离子方程式为。
(2)装置A的烧瓶中可装试剂。
(3)B装置的名称是;E装置的作用。
(4)通入C装置的两根导管左边较长、右边较短,目的是。
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:。
当有a mol氯气参加反应时,转移的电子总数为b个,则伏加德罗数常数为(用含a、b的代数式表示)
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?
。
实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH,利用如图装置进行中和热的测定,请回答下列问题:
(1) 不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是_________。
(2)如用0.50 mol·L-1盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将________(填“偏大”、“偏小”、“不变”)
(3)实验得到表中的数据:
| 实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
|
| 盐酸 |
NaOH溶液 |
||
| 1 |
20.2 |
20.3 |
23.7 |
| 2 |
20.3 |
20.5 |
23.8 |
| 3 |
21.5 |
21.6 |
24.9 |
经数据处理,t2-t1=3.4℃。则该实验测得的中和热 ΔH =________。
(12分)欲配制一定温度下的某NaOH溶液,已知:该溶液体积为V mL,溶液密度为d g/cm3,质量分数(质量百分比浓度)为w%,物质的量浓度为c mol/L,溶液中含氢氧化钠的质量为m g. 试回答下列问题.
(1)计算:用w、d表示溶液中溶质的物质的量浓度c为________________.
(2)某学生用托盘天平称量小烧杯的质量(烧杯中盛NaOH),称量前把游码放在标尺的零刻度,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将________________(填“高于”或“低于”)右边的托盘,欲使天平平衡,所进行的操作为____________________________,假定最终称量小烧杯的质量为________________(填“32.6 g”或“32.61 g”).
(3)在标尺(图)上画出游码位置(画“△”表示).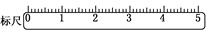
(4)定容后将溶液振荡均匀,静置时发现液面低于刻度线,于是又加少量水至刻度线,则测得溶液的物质的量浓度将__________________(填“偏大”、“偏小”或“无影响”).
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有 ;
(2)硫酸铜溶液可以加快氢气生成速率的原因是 ;
(3)实验室中现有 、
、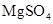 、
、 、
、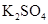 等4中溶液,可与实验中
等4中溶液,可与实验中 溶液起相似作用的是 ;
溶液起相似作用的是 ;
(4)要加快上述实验中气体产生的速率,还可采取的措施有 (答两种);
|
|
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。

 溶液时,生成氢气的速率会大大提高。但当加入的
溶液时,生成氢气的速率会大大提高。但当加入的 溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
50 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液在下图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
⑴大小烧杯间填满碎泡沫塑料的作用___。
⑵(填“能”或“不能”)将环形玻璃搅拌棒改为环形铜棒。其原因是。
⑶大烧杯上如不盖硬纸板,对求得中和热数值的影响是(填“偏高”或“偏低”或“无影响”)。
⑷如果改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量(“增加”、 “减少”或“不变”),理由是;所求中和热数值(“增加”、 “减少”或“不变”),理由是。