某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。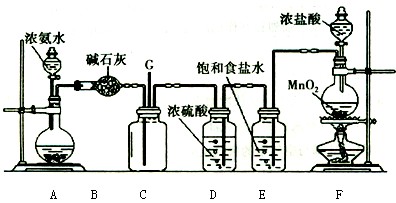
请回答下列问题:
(1)装置F中发生反应的离子方程式为 。
(2)装置A的烧瓶中可装试剂 。
(3)B装置的名称是 ;E装置的作用 。
(4)通入C装置的两根导管左边较长、右边较短,目的是 。
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式: 。
当有a mol氯气参加反应时,转移的电子总数为b个,则伏加德罗数常数为(用含a、b的代数式表示)
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?
。
实验室以废铜屑为原料制取碱式碳酸铜【Cu2(OH)2CO3】的步骤如下:
步骤一:废铜屑制硝酸铜
如图,
用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
步骤三:碱式碳酸铜的组成测定
碱式碳酸铜可表示为:xCuCO3 ·yCu (OH)2 ·zH2O,可采用氢气还原法来确定,其反应原理为:
xCuCO3 ·yCu (OH)2 ·zH2O + H2→ Cu + CO2 + H2O(未配平)
完成下列填空:
(1)步骤一中,反应开始时,瓶内的现象是,
用该装置制取硝酸铜,好处是。
(2)步骤二中,水浴加热所需仪器有、(加热、夹持仪器、石棉网除外);洗涤的目的是。
(3) 步骤三中,①以字x、y、z母为系数,配平氢气还原法的化学方程式:
xCuCO3 ·yCu (OH)2 ·zH2O+ H2→Cu+ CO2+ H2O
②称取24.0g某碱式碳酸铜样品,充分反应后得到12.8 g残留物,生成4.4g二氧化碳和7.2g水。该样品中结晶水质量为g,化学式为。
大理石中含有的主要杂质是氧化铁,以下是某化学兴趣小组用大理石为原料制取安全无毒杀菌剂过氧化钙的主要流程: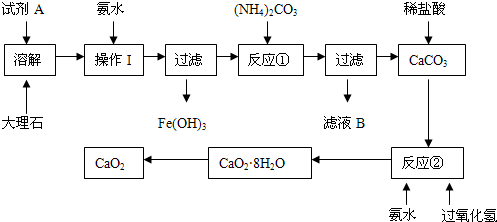
请回答下列问题:
(1)试剂A的名称是;
(2)操作I的目的是;
(3)本实验需要多次使用玻璃棒,则本实验过程中玻璃棒的作用有;
(4)写出反应②中生成CaO2·8H2O的化学方程式:;
(5)制得的CaO2中一般含有CaO该化学兴趣小组通过实验测定制得的样品中CaO2的含量:称量0.6g样品于锥形瓶中,然后加入过量的浓度为2.00mol•L-1的盐酸20.00mL,再用浓度为2.00mol•L-1的氢氧化钠溶液滴定锥形瓶中的溶液,消耗氢氧化钠溶液11.00mL.该样品中CaO2的质量分数为。
氯气可与潮湿的消石灰反应制取少量漂白粉,也可在浓溶液条件下与石灰石反应生成较浓的HClO溶液。
Ⅰ.甲研究性学习小组利用氯气制少量漂白粉(如图所示):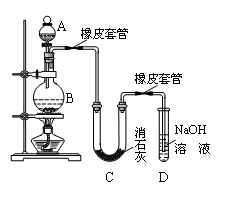
(1)A仪器的名称是,所盛试剂是。
(2)此实验结果所得Ca(ClO)2产率太低。经分析并查阅资料发现主要原因是在U型管中存在两个副反应:
①温度较高时氯气与消石灰反应生成了Ca(ClO3)2,为避免此副反应的发生,可采取的措施是。此副反应的化学方程式为:。
②写出另一个副反应的化学方程式。为避免此副反应发生,可在BC之间加多一个装置,请在答题卷的方框中画出该装置,并标明所用的试剂。
Ⅱ. 乙研究性学习小组研究饱和氯水与石灰石的反应:
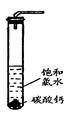
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水(如图所示),充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。 经检测,上述实验中产生的无色气体均为CO2。请回答:
(3)反应后所得的溶液漂白性增强的原因是。
(4)依据上述实验可推知:②的滤液中的溶质除CaCl2、HClO外,还含有。
纯碱、烧碱等是重要的化工原料。
(1)利用下图所示装置可间接证明二氧化碳与烧碱溶液发生了反应:将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是,反应的离子方程式是_______。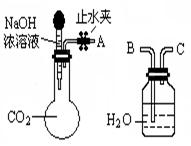
(2)向100 mL2 mol/L的NaOH 溶液中通入一定量CO2,充分反应后将溶液在一定条件下蒸发结晶,得到少量的白色固体。试设计实验确认该白色固体的成分。
①提出合理假设。
假设1:该白色固体为NaOH和Na2CO3;
假设2:该白色固体为只有Na2CO3;
假设3:该白色固体为只有NaHCO3;
假设4:该白色固体为Na2CO3和NaHCO3
②基于假设4,设计实验方案进行实验证明固体的成分是Na2CO3和NaHCO3。请在答题卡上写出实验步骤及预期现象和结论。(步骤可不填满也可增加)
限选实验试剂及仪器: 1moL·L–1HCl溶液、1mol·L–1 MgCl2溶液、0.5mol·L–1BaCl2溶液、1mol·L–1 Ba(OH)2溶液、甲基橙试液、酚酞试液、试管、胶头滴管、过滤装置。
| 实验步骤 |
预期现象和结论 |
| 步骤1: |
|
| 步骤2: |
(14分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:

现称取研细的黄铜矿样品1.150 g,在空气存在下进行煅烧,生成Cu、Fe2O3、FeO和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05000 mol·L-1标准碘溶液进行滴定,初读数为0.10 mL,末读数如右图所示。
(1)冶炼铜的反应为8CuFeS2+ 21O2 高温8Cu + 4FeO + 2Fe2O3+ 16SO2,若CuFeS2中Fe的化合价为+2,反应中被还原的元素是(填元素符号)。
(2)装置a的作用是。
| A.有利于空气中氧气充分反应 | B.除去空气中的水蒸气 |
| C.有利于气体混合 | D.有利于观察空气流速 |
(3)上述反应结束后,仍需通一段时间的空气,其目的是。
(4)滴定时,标准碘溶液所耗体积为mL。用化学方程式表示滴定的原理:。
(5)通过计算可知,该黄铜矿的纯度为。