氯气可与潮湿的消石灰反应制取少量漂白粉,也可在浓溶液条件下与石灰石反应生成较浓的HClO溶液。
Ⅰ.甲研究性学习小组利用氯气制少量漂白粉(如图所示):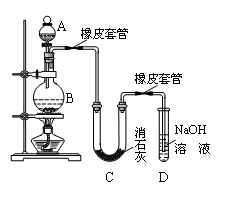
(1)A仪器的名称是 ,所盛试剂是 。
(2)此实验结果所得Ca(ClO)2产率太低。经分析并查阅资料发现主要原因是在U型管中存在两个副反应:
①温度较高时氯气与消石灰反应生成了Ca(ClO3)2,为避免此副反应的发生,可采取的措施是 。此副反应的化学方程式为: 。
②写出另一个副反应的化学方程式 。为避免此副反应发生,可在BC之间加多一个装置,请在答题卷的方框中画出该装置,并标明所用的试剂。
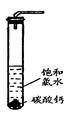
Ⅱ. 乙研究性学习小组研究饱和氯水与石灰石的反应:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水(如图所示),充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。 经检测,上述实验中产生的无色气体均为CO2。请回答:
(3)反应后所得的溶液漂白性增强的原因是 。
(4)依据上述实验可推知:②的滤液中的溶质除CaCl2、HClO外,还含有 。
(19分)晶体硅是信息科学和能源科学中的一种重要材料,可用于制芯片和太阳能电池等,.以下是工业上制取纯硅的一种方法.
已知:在一定条件下可发生反应:Si(s)+3HCl(g)  SiHCl3(g)+H2(g) ΔH<0
SiHCl3(g)+H2(g) ΔH<0
I.反应②、③均需要加热,有如下两个温度区间分别供两反应选择,你认为反应②应选择_______(填序号字母),原因是_______________;
a .520~530K B.1350~1360K
II.现在实验室模拟工业上粗硅提纯的过程,已知SiHCl3遇水强烈水解,其他相关数据如下表所示:
| 物质 |
SiCl4 |
SiHCl3 |
AlCl3 |
FeCl3 |
| 沸点/℃ |
57.7 |
33.0 |
- |
315 |
| 升华温度/℃ |
- |
- |
180 |
300 |
(1)现用如下装置进行模拟反应②的过程。实验室制HCl的反应原理为:
2NaCl(s) + H2SO4(浓)  2HCl↑ + Na2SO4
2HCl↑ + Na2SO4
A中是HCl的发生装置,你认为应选择下列哪套装置?____________(填装置的序号字母),装置D中碱石灰的作用为__________________、___________________;
(2)已知液态粗品SiHCl3中含有杂质SiCl4、AlCl3、FeCl3等,则流程中操作①为_____________(填操作名称),下列不是该操作所需的仪器是____________________(填装置序号字母);
a.冷凝管 b. 圆底烧瓶 c. 蒸馏烧瓶 d. 分液漏斗 e.温度计 f. 接受器
(3)用SiHCl3与H2反应制备纯硅的装置如下:
①按图示组装好仪器后,下列实验步骤的正确顺序为____________(填步骤的序号字母),
A.打开甲装置分液漏斗旋塞,滴加稀硫酸,反应生成H2;
B.向装置中添加药品;
C.打开丙装置分液漏斗的旋塞,滴加SiHCl3,并加热相应装置;
D.检查装置气密性;
e.停止向丙装置滴加SiHCl3,并停止加热相应装置;
f.停止通H2;
步骤c中需要加热的装置为____________(填装置序号“甲”、“乙”、“丙”、“丁”)
②该套装置的设计缺陷是________________________。
实验室用氯化钠固体配制1.00 mol/L的NaCl溶液0.5 L,回答下列问题:
(1)请写出该实验的实验步骤:
① ,② ,③ ,④ ,⑤ ,⑥ 。
(2)所需仪器为:容量瓶 (规格: )、托盘天平、还需要那些实验仪器才能完成该实验,请写出: 。
(3)试分析下列操作对所配溶液的浓度有何影响及造成该影响的原因。
①为加速固体溶解,可稍微加热并不断搅拌。在未降至室温时,立即将溶液转移至容量瓶定容。对所配溶液浓度的影响: ,原因是: 。
②定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响: ,原因是: 。
分离和提纯在生产和生活中得以广泛应用,请完成以下两个小题:
ⅰ、我们饮用的水是由原水净化所得。原水中含有泥沙、悬浮物和细菌等杂质。家庭的饮用水可经过如下的净化步骤:
则:(1)可以除去大颗粒悬浮物质的步骤是_____________。
(2)能消毒杀菌的步骤是___________。
ⅱ、下列操作过程中采用了哪些分离或提纯的方法?
①分离食盐与碳酸钙混合物:__________________________________;
②从溴水中提取单质溴(溴的性质与碘的相似):_________________;
③酿酒时提高酒的度数:_____________;④古代制盐;___________________;
⑤常用海水淡化:_______________________;⑥油水分离:___________________;
某校课外小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验.
方案Ⅰ.甲组同学用质量法,按如下图所示的实验流程进行实验:
(1)实验时,蒸发结晶操作中,除了酒精灯外,还要用到的仪器是
(2)有同学认为“加入适量盐酸”不好操控,应改为“过量盐酸”,便于操作且不影响测定的准确性,你认为对或错 ,为什么
(3)若实验中测得样品质量为46.4g,固体质量为40.95g,则碳酸钠的质量分数为 .(保留3位有效数字)
(4)蒸发结晶过程中若有固体飞溅,测得碳酸钠的质量分数 (填偏大 偏小 无影响).
方案Ⅱ:乙组同学的主要实验流程图如下:
按如下图所示装置进行实验:
(5)在C中装碱石灰来吸收净化后的气体.D装置的作用是 .
(6)有的同学认为为了减少实验误差,在反应前后都通入N2,反应后通入N2的目的是 .
方案Ⅲ:气体分析法
(7)把一定量样品与足量稀硫酸反应后,用如图装置测量产生CO2气体的体积,B溶液最好采用 (以下选项中选择)使测量误差较小.
| A.饱和碳酸钠溶液 | B.饱和碳酸氢钠溶液 |
| C.饱和氢氧化钠溶液 | D.饱和硫酸铜溶液 |
(11 分)钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。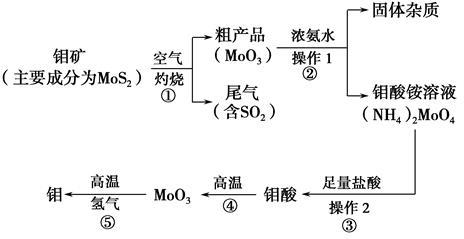
(1)反应①的尾气可以用NH3•H2O溶液吸收合成肥料,写出反应的离子方程式 .
(2)钼酸铵溶液中的主要阳离子的检验方法: .
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有 。
(4)写出反应①的化学方程式: 。
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH4 2CO+2H2,
2CO+2H2,
CH4+H2O CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为 。
CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为 。