某研究性学习小组从网上查到绿矾(FeSO4·7H2O)受热分解的方程式为:
2FeSO4·7H2O Fe2O3+SO3↑SO3↑+14H2O↑,就设计了如下实验装置来验证绿矾受热分解是否发生上述反应。
Fe2O3+SO3↑SO3↑+14H2O↑,就设计了如下实验装置来验证绿矾受热分解是否发生上述反应。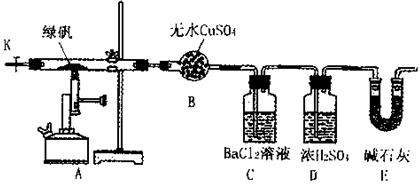
主要实验步骤如下:
①组装仪器并检查装置的气密性;
②称量绿矾样口及U型干燥管E的质量,将称量后的绿矾置于硬质玻璃管内;
③关闭活塞K,加强热使绿矾完全分解;
④打开活塞K,缓缓鼓入一定量的氮气;
⑤再次称量干燥管E的质量;
⑥重复④⑤的操作,直到干燥管E的质量基本不变为止;
⑦称量洗气瓶C中所得沉淀的质量。
试回答:
(1)洗气瓶D中浓H2SO4的作用为: ;
(2)步骤⑦从溶液中获取生成沉淀质量的具体操作为: ;
(3)实验小组的报告如下,请补充完整:
| |
实验记录 |
分析或计算结果 |
| 现象 |
硬质管内绿色变为红棕色; |
生成物有 |
| 干燥管B中晶体白色变蓝色。 |
生成物有H2O |
|
| 数据 |
称取绿矾样品16.68g; |
反应的绿矾0.06mol |
| 干燥管E最后增重2.24g; |
生成SO2 mol |
|
| C中生成白色沉淀的质量为4.66g; |
生成DO3 0.02mol |
(4)该实验所得到的数据与所样到的化学方程式中的定量关系不相符合,请分析可能的原因。
(5)为达到“验证绿矾受热分解是否发生上述反应”的目的,该实验的设计有多处不妥,请提出改进建议(两条即可)

 某温度时,在2L密闭容器中气态物质
和
反应生成气态物质
,它们的物质的量随时间的变化如表所示。
某温度时,在2L密闭容器中气态物质
和
反应生成气态物质
,它们的物质的量随时间的变化如表所示。
 (1)根据左表中数据,在右图中画出
、
、
的物质的量(
)随时间(
)变化的曲线:
(1)根据左表中数据,在右图中画出
、
、
的物质的量(
)随时间(
)变化的曲线:
| t/min |
X/mol |
Y/mol |
Z/mol |
| 0 |
1.00 |
1.00 |
0.00 |
| 1 |
0.90 |
0.80 |
0.20 |
| 3 |
0.75 |
0.50 |
0.50 |
| 5 |
0.65 |
0.30 |
0.70 |
| 9 |
0.55 |
0.10 |
0.90 |
| 10 |
0.55 |
0.10 |
0.90 |
| 14 |
0.55 |
0.10 |
0.90 |


 (2) 体系中发生反应的化学方程式是;
(2) 体系中发生反应的化学方程式是;
 (3) 列式计算该反应在0-3min时间内产物
的平均反应速率:;
(3) 列式计算该反应在0-3min时间内产物
的平均反应速率:;
 (4) 该反应达到平衡时反应物
的转化率
等于;
(4) 该反应达到平衡时反应物
的转化率
等于;
 (5) 如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的实验条件改变分别是:
(5) 如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的实验条件改变分别是:
 ①②③
①②③




和
元素在化学中占有极其重要的地位。 (1)写出
的基态原子核外电子排布式。
(1)写出
的基态原子核外电子排布式。 从电负性角度分析,
、
和
元素的非金属活泼性由强至弱的顺序为。
从电负性角度分析,
、
和
元素的非金属活泼性由强至弱的顺序为。 (2)
的晶体结构与晶体硅的相似,其中
原子的杂化方式为,微粒间存在的作用力是。
(2)
的晶体结构与晶体硅的相似,其中
原子的杂化方式为,微粒间存在的作用力是。 (3)氧化物
的电子总数与
的相等,则
为填元素符号)。
是优良的耐高温材料,其晶体结构与
晶体相似。
的熔点比
的高,其原因是。
(3)氧化物
的电子总数与
的相等,则
为填元素符号)。
是优良的耐高温材料,其晶体结构与
晶体相似。
的熔点比
的高,其原因是。 (4)
、
为同一主族的元素,
和
化学式相似,但结构和性质有很大不同。
中
与
原子间形成
(4)
、
为同一主族的元素,
和
化学式相似,但结构和性质有很大不同。
中
与
原子间形成 键和
键,
中
与
原子间不形成上述
健。从原子半径大小的角度分析,为何
、
原子间能形成,而
、
原子间不能形成上述
键。
键和
键,
中
与
原子间不形成上述
健。从原子半径大小的角度分析,为何
、
原子间能形成,而
、
原子间不能形成上述
键。

 金属铝的生产是以
为原料,在熔融状态下进行电解:
金属铝的生产是以
为原料,在熔融状态下进行电解:
请回答下列问题: (1)冰品石(
)的作用是。
(1)冰品石(
)的作用是。 (2)电解生成的金属铝是在熔融液的(填"上层"或"下层")。
(2)电解生成的金属铝是在熔融液的(填"上层"或"下层")。 (3)阴极和阳极均由材料做成;电解时所消耗的电极是(填"阳极"或"阴极")。
(3)阴极和阳极均由材料做成;电解时所消耗的电极是(填"阳极"或"阴极")。 (4)铝是高耗能产品,废旧铝材的回收利用十分重要。在工业上,最能体现节能减排思想的是将回收铝做成(填代号)。
(4)铝是高耗能产品,废旧铝材的回收利用十分重要。在工业上,最能体现节能减排思想的是将回收铝做成(填代号)。 a.冰品石 b.氧化铝 c.铝锭 d.硫酸铝
a.冰品石 b.氧化铝 c.铝锭 d.硫酸铝
干电池应用广泛,其电解质溶液是
混合溶液。 (1)该电池的负极材料是。电池工作时,电子流向(填"正极"或"负极")。
(1)该电池的负极材料是。电池工作时,电子流向(填"正极"或"负极")。 (2)若
混合溶液中含有杂质
,会加速某电极的腐蚀,其主要原因是。欲除去
,最好选用下列试剂中的(填代号)。
(2)若
混合溶液中含有杂质
,会加速某电极的腐蚀,其主要原因是。欲除去
,最好选用下列试剂中的(填代号)。 .
.
.
.
.
.
.
.
(3)
的生产方法之一是以石墨为电极,电解酸化的
溶液。阴极的电极反应式是 。若电解电路中通过2
电子,
的理论产量为。
。若电解电路中通过2
电子,
的理论产量为。
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。 (1)合成氨反应反应
(1)合成氨反应反应
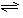 ,若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填"向左""向右"或"不");,使用催化剂反应的
(填"增大""减小"或"不改变")。
,若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填"向左""向右"或"不");,使用催化剂反应的
(填"增大""减小"或"不改变")。 (2)
(2)
 则反应
的
=
。
则反应
的
=
。 (3)在25℃下,向浓度均为0.1
的
和
混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为。已知25℃时
=1.8×10-11,
=2.2×10-20。
(3)在25℃下,向浓度均为0.1
的
和
混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为。已知25℃时
=1.8×10-11,
=2.2×10-20。
 (4)在25℃下,将
的氨水与0.01
的盐酸等体积混合,反应平衡时溶液
则溶液显性(填"酸""碱"或"中");用含
的代数式表示
的电离常数
=。
(4)在25℃下,将
的氨水与0.01
的盐酸等体积混合,反应平衡时溶液
则溶液显性(填"酸""碱"或"中");用含
的代数式表示
的电离常数
=。