下图是中学化学中常见物质之间的相互转化关系。其中C可用于漂白,空气中M含量增加会导致温室效应。反应③常用于实验室制取气体B。

请回答下列问题:
⑴ C的分子式为 ,J的电子式为 。
⑵ 写出反应①的离子方程式 。
⑶ 写出反应②的化学方程式 。
⑷ C、M有相似的化学性质,但也有区别,如C有漂白性、M五漂白性。 C、M具有其他不同化学性质的原因是 。
工业上处理含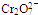 的酸性工业废水用以下方法:
的酸性工业废水用以下方法:
①往工业废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成;③过滤回收沉淀,废水达排放标准。试回答:
(1)电解时的电极反应,阳极__________________________,阴极________________。
(2)写出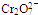 转变成Cr3+的离子反应方程式
转变成Cr3+的离子反应方程式
_______________________________________________
________________________________________________________________________。
(3)电解过程中Cr(OH)3和Fe(OH)3沉淀是怎样产生的?________________________________________________________________________
________________________________________________________________________。
(4)能否将Fe电极改成石墨电极?为什么?
________________________________________________________________________。
测定铜合金中铜的含量,可以用稀硝酸来溶解样品,也可以用双氧水和稀盐酸溶解样品,其反应的化学方程式为:Cu+H2O2+2HCl===CuCl2+2H2O。假设样品中其他成分不与稀硝酸、双氧水和盐酸反应。
(1)写出铜与稀硝酸反应的离子方程式并标出电子转移的方向和数目________________________________________________________________________。
(2)在铜与双氧水、盐酸的反应中氧化剂是________,若有2 mol的H2O2参加反应,则电子转移的物质的量是______________。
(3)用双氧水和稀盐酸溶解样品与用稀硝酸溶解样品相比较,哪种更好?为什么?
________________________________________________________________________。
实验证明铜在低温下不能和O2发生反应,也不能和稀硫酸共热发生反应,但工业上却是将废铜屑倒入热的稀硫酸中并不断地通入空气来制取CuSO4溶液的。铜屑在此状态下发生的一系列反应的化学方程式为:________________________________________________________________________
________________________________________________________________________。
利用铜与浓硫酸在加热条件下也能制备CuSO4溶液,其化学方程式为________________________________________________________________________。
以上两种方法前者好还是后者好?原因是什么?________________________________________________________________________
________________________________________________________________________。
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用左图所示实验装置,则可制得纯净的Fe(OH)2白色沉淀。已知两极材料分别为石墨和铁: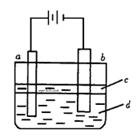
(1)a极材料为,电极反应式为。
(2)电解液d可以是,则白色沉淀在电极上生成;电解液d也可
以是,则白色沉淀在两极间的溶液中生成。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是,在加苯之前对d溶液
进行加热煮沸处理,目的是。
(4)为了在短时间内看到白色沉淀,可以采取的措施是。
A.改用H2SO4作电解液 B.适当增大电源电压
C.适当缩小两极间距离 D.适当地降低电解液的温度
(5)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源继续电解,除了电极上看到的气泡外,另一明显的现象为。
现有下列仪器:①铁架台(含铁夹、铁圈)②锥形瓶③酸式滴定管和碱式滴定管
④烧杯⑤玻璃棒⑥胶头滴管 ⑦天平 ⑧滤纸⑨量筒⑩ 漏斗,请回答:
(1)过滤时应选用的仪器是__(填编号)
(2)配制一定物质的量浓度的NaOH溶液时,还缺少的仪器是__
(3)进行中和滴定时,不需用将要盛的溶液事先润洗的是__(填编号)
| A.酸式滴定管 | B.碱式滴定管 | C.25ml量筒 | D.锥形瓶 |