以下是合成聚酯类高分子材料的路线:
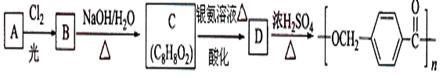
 已知:
已知:
 同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮:
同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮:

 请根据以上信息回答下列问题:
请根据以上信息回答下列问题: (1)由A生成B的化学方程式为 ;
(1)由A生成B的化学方程式为 ; (2)C的结构简式为 ;
(2)C的结构简式为 ; (3)由C生成D的离子方程式为 ;
(3)由C生成D的离子方程式为 ; (4)D的同分异构体中含有苯环且水解产物之一为乙酸的有 种。
(4)D的同分异构体中含有苯环且水解产物之一为乙酸的有 种。
下列物质:①H2O ②NaCl ③H2SO4④Ca(OH)2⑤Fe2O3⑥CuSO4·5H2O ⑦HNO3⑧AgNO3⑨NaHCO3其中属于氧化物的是________,属于碱的是________,属于酸的是________,属于盐的是______
用晶体的X射线衍射法对Cu的测定得到以下结果:Cu的晶胞为面心立方最密堆积(如右图),已知该晶体的密度为9.00 g·cm-3,晶胞中该原子的配位数为________;Cu的原子半径为________cm(阿伏加德罗常数为NA,列出计算表达式,不用化简)。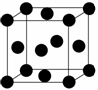
过渡元素在生活、生产和科技等方面有广泛的用途。
(1)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色,据此判断,[Mn(H2O)6]2+________(填“有”或“无”)颜色。
(2)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子。下列说法中不正确的是________。(填序号)
| A.PFS中铁显+3价 |
| B.铁原子的外围电子排布式是3d64s2 |
| C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程 |
| D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难 |
| 元素 |
Mn |
Fe |
|
| 电离能 |
I1 |
717 |
759 |
| (kJ·mol-1)[ |
I2 |
1 509 |
1 561 |
| I3 |
3 248 |
2 957 |
(3)铬的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用。现有铬(Ⅲ)与甲基丙烯酸根的配合物为:
①该化合物中存在的化学键类型有______________________________。
②甲基丙烯酸分子中C原子的杂化方式有________。
③等电子体是具有相同的价电子数和原子数的分子或离子,与H2O分子互为等电子体的微粒是________(填一种即可)。
④与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是________(填元素符号)。
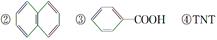
Ⅰ.有下列四种含苯环的有机物: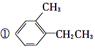
按要求回答下列问题:
(1)属于苯的同系物的是______。(填序号,下同)
(2)属于芳香族化合物的是____________。
(3)属于芳香烃的是________。
(4)用图示画出上述三类物质之间的包含关系。
Ⅱ.迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图所示。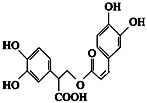
该物质中含有的官能团有______________________。
铁和铝是两种重要的金属,它们的单质及其化合物有着各自的性质。
(1)现配制100mL 0.01mol∙L-1 FeCl3溶液,配制过程中需要的玻璃仪器除量筒、胶头滴管、烧杯外,还需要 。
(2)将FeCl3溶液滴入沸水可得到红褐色液体,反应的离子方程式是 。此液体具有的性质是 (填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.将该液体进行过滤,可得到红褐色固体
c.向该液体中加入硝酸银溶液,无沉淀产生
d.该液体显酸性
(3)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2,其中S为-1价)氧化为Fe2(SO4)3,并使溶液酸性增强。
①该过程反应的化学方程式为_______________________________________。
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:
_____Cu2S+____Fe3++___H2O ___Cu2++____Fe2++___( )+___SO42-
___Cu2++____Fe2++___( )+___SO42-
(4)羟胺(NH2OH)是一种还原剂,用25.0 mL 0.49 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.20 mol/L的KMnO4酸性溶液反应(反应后MnO4-离子变成Mn2+)。则在上述反应中,羟胺的氧化产物中N的化合价是 。