A、B、C、D、E为主族元素。A、B、C 同周期且原子半径逐渐减小,A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和。A元素的最外层电子数为次外层电子数的两倍,B的氢化物可与它的最高价氧化物的水化物反应生成盐。D元素位于元素周期表中第一个长周期,是维持青少年骨骼正常生长发育的重要元素之一,其原子最外层电子数等于最内层电子数。E是元素周期表中原子半径最小的元素。试回答下列问题:
同周期且原子半径逐渐减小,A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和。A元素的最外层电子数为次外层电子数的两倍,B的氢化物可与它的最高价氧化物的水化物反应生成盐。D元素位于元素周期表中第一个长周期,是维持青少年骨骼正常生长发育的重要元素之一,其原子最外层电子数等于最内层电子数。E是元素周期表中原子半径最小的元素。试回答下列问题:
(1)C元素简单离子的电子排布图是 。
(2)A、B两元素各有多种氢化物,其电子数为10的氢化物中沸点较高的是 (填化学式)。
(3)B与E可形成离子化合物BE5,其阴离子的电子式是 ,BE5含有的化学键类型有  (选填代号:A.离子键 B.极性键 C.非极性键 D.配位键)。
(选填代号:A.离子键 B.极性键 C.非极性键 D.配位键)。
(4)下列晶体结构示意图中(●代表阳离子,○代表阴离子),能表示C与D形成的离子化合物的晶体结构的是 (选填字母标号“a”或“b”)。
根据下列的有机物合成路线回答问题:
(1)写出A、B的结构简式:
A 、B 。
(2)写出各步反应类型:
①、②、③。
(3)写出②、③的反应方程式:
②,
③。
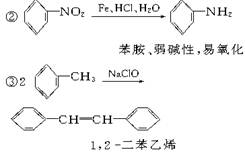
请认真阅读下列三个反应:
利用这些反应,按以下步骤可从某烃A合成一种染料中间体DSD酸。(试剂和条件已略去)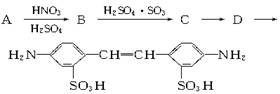
请写出A、B、C、D的结构简式。
A_______________; B______________C___________ ;D_________________ 。
(10分)⑴键线式 表示的分子式;名称是。
表示的分子式;名称是。
⑵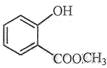 中含有的官能团的名称为。
中含有的官能团的名称为。
⑶丁基的4个结构简式为_________________________________________________________
⑷含有杂质的工业乙醇的蒸馏装置中,玻璃仪器有酒精灯、蒸馏瓶、_________、_________、尾接管、锥形瓶
.(5分)利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖。在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。例如二乙醚的结构简式为:
CH3—CH2—O—CH2—CH3
其核磁共振谱中给出的峰值(信号)有两个,如图所示:
(1) 下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是。
| A.CH3CH3 | B.CH3COOH |
| C. CH3COOCH3 | D. CH3OCH3 |
(2) 化合物A和B的分子式都是C2H4Br2, A的核磁共振氢谱图如图所示,则A的结构简式为:,请预测B的核磁共振氢谱上有个峰(信号)。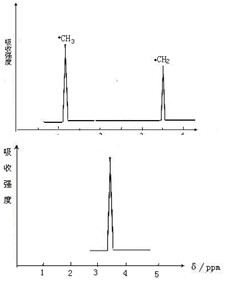
(3)用核磁共振氢谱的方法来研究C2H6O的结构,简要说明根据核磁共振氢谱的结果来确定C2H6O分子结构的方法是
. (8分)X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化: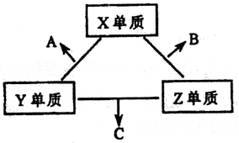
一个B分子中含有的X原子个数比A分子中多1个。请回答下列问题:
(1)分析同主族元素性质的递变规律,发现A、B物质沸点反常,这是因为它们的分子之间存在_____________。
(2) B在一定条件下反应生成C的化学方程式是__。
(3)最近科学家们合成了由Z元素形成的Z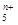 ,电子式为
,电子式为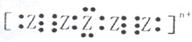 则n值____________________。
则n值____________________。