如下图的转化关系中,已知A是由短周期元素组成的酸式盐。D、Y、H为气体,X为无色液体,G和K均是常见的强酸。H与Na2O2可发生化合反应 ,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。
,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。
试回答下列问题:
(1)D的电子式为:___________________;
(2)写出D+H+X→A的化学方程式:________;
(3)写出C→H的离子方程式:_______________;
(4)写出D与K反应生成的正盐溶液中的离子浓度大小关系:____________________;
(5)已知1molH(g)完全转化为I(g)时放热98.3kJ,则此反应的热化学方程式为_________;
某条件下,当加入4 mol H和2 mol Y后,放出314.56 kJ的热时,此时H的转化率为__________;
(6)一定温度下,有可逆反应:aD(g)+bY(g) cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
(1) 在下列化合物中:H2O2、Na2O、、I2 、、NaCl、、CO2、NH4Cl、Na2O2,用化学式回答下列问题:
在下列化合物中:H2O2、Na2O、、I2 、、NaCl、、CO2、NH4Cl、Na2O2,用化学式回答下列问题: 只由非金属组成的离子化合物是,
只由非金属组成的离子化合物是,
只有极性共价键的共价化合物是, 只含有非极性共价键的是,
只含有非极性共价键的是,
既有离子键又有非极性键的化合物是。
(2)在下列物质中,①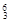 Li ②
Li ② Na ③
Na ③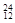 Mg ④
Mg ④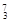 Li ⑤
Li ⑤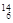 C ⑥C60⑦石墨,为同位素的是,互为同素异形体的是。(填编号)
C ⑥C60⑦石墨,为同位素的是,互为同素异形体的是。(填编号)
I.在一定条件下,反应A(气)+B(气) C(气)+Q达到平衡后,根据下列图象判断
C(气)+Q达到平衡后,根据下列图象判断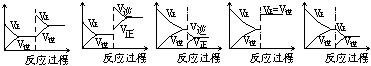
| A. | B. | C. | D. E. |
(1)升温,达到新的平衡的是 (2)降压,达到新的平衡的是
(3)减少C的量,移向新平衡的是(4)增加A的量,移向新平衡的是
(5)使用催化剂,达到平衡的是
II. CuCl2溶液有时呈黄色,有时呈黄绿色或蓝色,这是因为在CuCl2的水溶液中存在如下
平衡:[Cu(H2O)4]2++4C1一 [CuCl4]2- +4H2O
[CuCl4]2- +4H2O
蓝色黄色
现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法
⑴⑵
依据事实,写出下列反应的热化学方程式。
(1)在25℃、101 kPa下,1 g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为______________________。
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量,则表示该反应的热化学方程式为_______________________________________________。
I. 一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO)∶CO(g)+2H2(g) CH3OH(g).
CH3OH(g).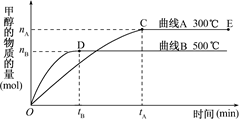
根据题意和所给图象完成下列各题:反应达到平衡时,平衡常数表达式K=,
(2)升高温度,K值(填“增大”“减小”或“不变”).
II. 可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答: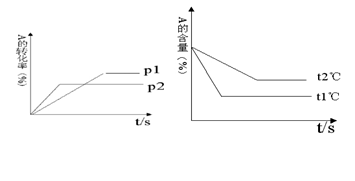
(1)压强 P1比P2(填大或小);(2)(a +b)比(c +d)(填大或小);
(3)温度t1℃比t2℃(填高或低);(4)正反应为反应。
向一体积不变的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图一所示.图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t3~t4阶段使用了催化剂;图一中t0~t1阶段c(B)未画出.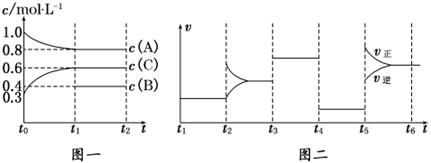
(1)若t1=15 min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=_______________.
(2)t4~t5阶段改变的条件为_______________,B的起始物质的量为_______________.
各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 |
t2~t3 |
t3~t4 |
t4~t5 |
t5~t6 |
| K1 |
K2 |
K3 |
K4 |
K5 |
则K1=_______________ (保留两位小数),K1、K2、K3、K4、K5之间的关系为____ (用“>”、“<”或“=”连接).