避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为: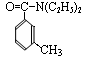
已知:RCOOH  RCOCl(酰氯);RCOCl + NH3→RCONH2 + HCl,
RCOCl(酰氯);RCOCl + NH3→RCONH2 + HCl,
避蚊胺在一定条件下,可通过下面的合成路线I来合成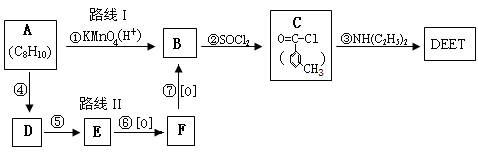
根据以上信息回答下列问题:
(1)由避蚊胺的结构简式推测,下列叙述正确的是 ▲ 。
| A.它能使酸性高锰酸钾溶液褪色 |
| B.它能发生酯化反应 |
| C.它与甲苯互为同系物 |
| D.一定条件下,它可与H2发生加成反应 |
(2)在反应①~⑦中,属于取代反应的有 ▲ (填序号)。
(3)写出下列化学反应方程式:
C→DEET ▲ ;
E→F ▲ 。
(4)经测定E的同分异构体能与FeCl3溶液发生显色的反应,且结构中不含乙基,试写出符合其条件的任意2个可能的结构简式 ▲ 。
(5)经核磁共振氢谱图显示A的某种同分异构体J只有两个吸收峰,试写出J的化学名称 ▲ ;J物质被酸性高锰酸钾氧化后得到的产物在一定条件下可与乙二醇反应,制成涤纶(聚酯纤维),试写出生产涤纶的化学方程式 ▲ 。
A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,甲、乙、丙为常见化合物。它们之间有如下转化关系。请回答:
(1)工业上冶炼B的常用方法为______________(填字母)
a.电解法 b.热还原法 c.热分解法
(2)丙的水溶液显性(填酸或碱),原因是(用离子方程式表示)
。
(3)D与甲溶液反应的化学方程式 。
(4)将C单质通入KI的碱性溶液中,可生成碘盐中的一种添加剂,试写出其反应的离子方程式:__________________________________________________。
(5)一定条件下,2molB与3molD的氧化物W恰好反应,则W的化学式。
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,。回答下列问题:
(1)写出一由A与C元素形成的阳离子的结构式___________;A、B、C、E四种元素都能与D元素形成原子个数比1:1化合物, 其中既含离子键,又含非极性共价键的是______________________(写化学式)
(2)A、B、D、E四种元素组成的某无机盐,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式
______________________________________________________________________。
(3)常温下,X、Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+ 浓度之比是_______________________________。
(4)1mol B的固体单质甲转化为1molB的另一种固体单质乙,吸收热量a kJ,已知甲的燃烧热为b kJ/mol,则乙的燃烧热为_______________________。
(5)化学反应:3A2(g)+C2(g) 2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),右图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是____________。温度为T ℃时,将4a mol A2和2a mol C2放入密闭容器中,充分反应后测得平衡混
2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),右图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是____________。温度为T ℃时,将4a mol A2和2a mol C2放入密闭容器中,充分反应后测得平衡混 合气中CA3的体积分数为50%,则此时C2的转化率为______________。
合气中CA3的体积分数为50%,则此时C2的转化率为______________。
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖。在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。例如二乙醚的结构简式为:
CH3—CH2—O—CH2—CH3
其核磁共振谱中给出的峰值(信号)有两个,如图所示:
(1)下列物质中,其核 磁共振氢谱中给出的峰值(信号)只有一个的是(多选扣分)。
磁共振氢谱中给出的峰值(信号)只有一个的是(多选扣分)。
A.CH3CH3B.CH3COOH
C.CH3COOCH3D.CH3OCH3
(2)化合物A和B的分子式都是C2H4Br2, A的核磁共振氢谱图如右图所示,则A的结构简式为:,请预测B的核 磁共振氢谱上有个峰(信号)。
磁共振氢谱上有个峰(信号)。
(3)已知某含C、H、O三种元素的未知物R,经燃烧分析实验测定该未知物碳的质量分数为52.16%,氢的质量分数为13.14%,且R的相对分子质量为46,试求R的分子式__________;用核磁共振氢谱的方法来研究R的结构,简要说明根据核磁共振氢谱的结果来确定R分子结构的方法是 。
。
(14分) (1)键线式 表示的分子式 _____;名称是。
表示的分子式 _____;名称是。
(2) 中含有的官能团的名称为。
中含有的官能团的名称为。
(3)写出符合分子式为C5H12的所有同分异构体的结构简式以及它们的习惯命名:
________________________________________________________________________________________
(4)含有杂质的工业乙醇的蒸馏装置中,玻璃仪器有酒精灯、蒸馏瓶、_________、_________、尾接管、锥形瓶。
(12分)下列有机物化合物中,有多个官能团。
(1)可以看作醇类的是:;(2)可以看作酚类的是;
(3)可以看作羧酸类的是:;(4)可以看作酯类的是:;
(5)可以看作醛类的是:;(6)可以看作醚类的是:。