有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图装置(夹持装置一起已省略),其实验操作为:先按图安装好,先关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞b和c,而有节奏(间歇性)通入气体,即可在M处观察到明显的实验现象。试回答下列问题: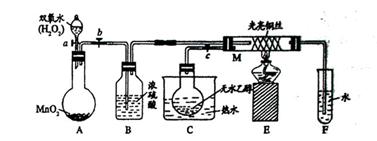
(1)C中热水的作用:
(2)M处发生的反应的化学方程式为:
(3)从M中可观察到的现象:
从中可认识到该实验过程中催化剂 (填“参加”或“不参加”)化学反应,还可以认识到催化作用需要一定的
(4)实验一段时间后,如果撤掉酒精灯,反应 (填“能”或“不能”)继续进行,其原因是
已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:N2 + 3H2 = 2NH3 ΔH="-92.4" KJ/mol,则N≡N键的键能是
| A.431 KJ/mol | B.946 KJ/mol | C.649 KJ/mol | D.869 KJ/mol |
已知2H2(g)+O2(g) =2H2O(l)ΔH=-569.6kJ/mol,
2H2O(g)=2H2(g)+O2(g) ΔH=+482.1 kJ/mol.
现有1 g液态H2O,蒸发时吸收的热量是
| A.2.43 kJ | B.4.86 kJ | C.43.8 kJ | D.87.5 kJ |
下列各组热化学方程式中,△H1>△H2的是
①C(s)+O2(g)=CO2(g)△H1 C(s)+1/2O2(g)=CO(g)△H2
②S(s)+O2(g)=SO2(g)△H1 S(g)+O2(g)=SO2(g)△H2
③H2(g)+1/2O2(g)=H2O(l)△H1 2H2(g)+O2(g)=2H2O(l)△H2
④CaCO3(s)=CaO(s)+CO2(g)△H1 CaO(s)+H2O(l)=Ca(OH)2(s)△H2
| A.① | B.④ | C.②③④ | D.①②③ |
在进行中和热的测定中,下列操作正确的是
| A.使用环形玻璃搅拌棒是为了加快反应速率,减小实验误差 |
| B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触 |
| C.用0.5 mol·L﹣1 NaOH溶液分别与0.5mol·L﹣1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同 |
| D.在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、滴定管、温度计 |
25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是
A.2H2(g)+O2(g) =2H2O(1)△H= ―285.8kJ/mol |
| B.2H2(g)+ O2(g) =2H2O(1)△H= +571.6 kJ/mol |
| C.2H2(g)+O2(g) =2H2O(g)△H= ―571.6 kJ/mol |
D.H2(g)+ O2(g) =H2O(1)△H= ―285.8kJ/mol O2(g) =H2O(1)△H= ―285.8kJ/mol |