下列叙述中正确的是 ( )
| A.因为NH3·H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3 |
| B.向Fel2溶液中通入少量Cl2,再滴加少量CCl4,振汤、静置,下层液体为紫色 |
| C.向一定体积的热浓硫酸中加入足量的铁粉,生成的气体能被烧碱溶液完全吸收 |
D.将SO2气体通入溴水,欲检验是否有SO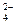 生成,可向溶液中滴加Ba(NO3)2溶液 生成,可向溶液中滴加Ba(NO3)2溶液 |
把0.05 mol NaOH固体分别加入到下列100 mL溶液中,导电能力变化较大的是 ( )
| A.0.5 mol/L MgSO4溶液 | B.0.5 mol/L盐酸 |
| C.0.5 mol/L的CH3COOH溶液 | D.0.5 mol/L NH4Cl溶液 |
已知在一定条件下2SO2(g)+O2(g) 2SO3(g) ΔH=-Q kJ·mol-1。向一密闭容器中加入2 mol SO2和1 mol O2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同容器中加入2 mol SO3,在相同条件下,达平衡时吸收的热量为Q2,则下列关系中正确的是( )
2SO3(g) ΔH=-Q kJ·mol-1。向一密闭容器中加入2 mol SO2和1 mol O2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同容器中加入2 mol SO3,在相同条件下,达平衡时吸收的热量为Q2,则下列关系中正确的是( )
| A.Q>Q1>Q2 | B.Q1>Q2>Q | C.Q1>Q>Q2 | D.Q1=Q2>Q |
下列说法不正确的是( )
| A.MnO2能加速H2O2的分解,是因为MnO2可以降低反应所需的活化能 |
| B.向橙色的K2Cr2O7溶液中滴加NaOH溶液,溶液颜色变黄,说明化学平衡发生了移动 |
| C.将NO2和N2O4混合气体的平衡体系加压,容器内气体颜色变深,这一事实不能用勒夏特列原理解释 |
D.在密闭容器中,对于反应2A(g)+B(g) 2C(g),增大压强后,平衡混合气的平均相对分子质量减小 2C(g),增大压强后,平衡混合气的平均相对分子质量减小 |
用50 mL 0.55 mol/L盐酸与50 mL 0.50 mol/L NaOH溶液进行中和热测定的实验,测量结果偏高的原因可能是( )
| A.实验装置保温、隔热效果差 |
| B.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度 |
| C.量取NaOH溶液的体积时仰视读数 |
| D.分多次把NaOH溶液倒入盛有盐酸的小烧杯中 |
下列说法正确的是( )
| A.氯化钾溶液在电流作用下电离成钾离子和氯离子 |
| B.二氧化硫溶于水能部分转化成离子,故二氧化硫属于弱电解质 |
| C.铜能导电,但铜是非电解质 |
| D.纯净的强电解质在液态时,有的导电有的不导电 |