下列为元素周期表的一部分,表中阿拉伯数字(1、2……)是原周期表中行或列的序号。请参照元素A~I在表中的位置,回答下列问题。
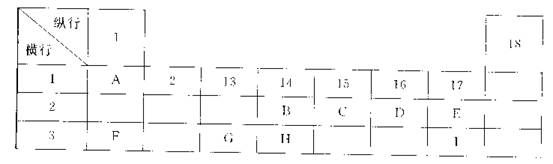
(1)B、C两元素中非金属性较强的是 (写出元素名称),请设计一个简单的实验证明这一结论 。
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1:1和1:2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素构成离子个数比为1:1和1:2的两种离子化合物Z和M。写出Z与Y反应的化学方程式: 。
|
(4)I元素在周期表里的位置在第 周期、第 族。
实验室中采用右图所示装置模拟工业上同时制取元素A和I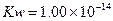 )
)