向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150mL4 mol·L-1的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
( )
| A.0.21mol | B.0.25mol | C.0.3mol | D.0.35mol |
X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质。已知:甲 + 乙 = 丁 + 己,甲 + 丙 = 戊 + 己;0.1 mol·L-1丁溶液的pH为13(25℃)。下列说法正确的是
| A.1 mol甲与足量的乙完全反应共转移了1 mol电子 |
| B.Y元素在周期表中的位置为第三周期第ⅣA族 |
| C.原子半径:W>Z>Y>X |
| D.1.0 L 0.1 mol·L-1戊溶液中阴离子总的物质的量小于0.1 mol |
由一种阳离子和两种酸根离子组成的盐称混盐。下列关于混盐Na4S2O3的有关判断,不正确的是
| A.向溶液中加入酚酞溶液变红,说明该混盐水溶液呈碱性 |
| B.向该混盐中加入稀H2SO4可以产生使品红褪色的气体 |
| C.该混盐在酸性条件下可以产生淡黄色浑浊 |
| D.用玻璃棒蘸取该混盐溶液灼烧,火焰呈黄色,说明溶液中含有Na+ |
下表中对应关系正确的是
| 化学方程式 |
结论 |
|
| A |
4CuO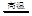 2Cu2O+O2↑ 2Cu2O+O2↑ |
热稳定性:Cu2O>CuO |
| B |
2KClO3+I2 2KIO3+Cl2 2KIO3+Cl2 |
非金属性:I>Cl |
| C |
H2S+CuSO4=CuS↓+H2SO4 |
酸性:H2S>H2SO4 |
| D |
CH3COOCH2CH3+H2O CH3COOH+CH3CH2OH CH3COOH+CH3CH2OH |
反应类型:既是水解反应,也是加成反应 |
常温下,下列各组离子在指定溶液中,一定能大量共存的是
| A.在0.1 mol·L-1NaOH溶液中:K+、Na+、SO42-、HCO3- |
| B.在0.1 mol·L-1Na2CO3溶液中:A13+、Na+、NO3-、C1- |
| C.在0.1 mol·L-1FeCl3溶液中:K+、NH4+、I-、SCN- |
| D.在c(H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO3- |
NA表示阿伏加德罗常数的值,下列有关说法正确的是
| A.反应KIO3+6HI=KI+3H2O+3I2,生成3mol I2转移电子的总数为6NA |
| B.由0.4 mol H2O2生成O2转移的电子数目为0.2NA |
| C.12g石墨和C60的混合物中质子总数为6NA |
| D.室温下,1L pH=13的NaOH溶液中,由水电离的OH- 离子数目为0.1NA |