一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2 X(g)+Y(g);=Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是( )
| A.将容器体积变为20 L,Z的平衡浓度变为原来的1/2 |
| B.以X浓度变化表示的反应速率为0.00l mol/(L·s) |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则正反应的△H>0 |
对于反应:TiCl4+4Na=4NaCl+Ti,下列说法正确的是
| A.该反应说明钠是强还原剂,可用于冶炼金属 |
| B.该反应条件是TiCl4在熔融状态或水溶液中 |
| C.Ti是氧化剂 |
| D.TiCl4是还原剂 |
下列离子方程式书写正确的是
| A.碳酸钙与醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
B.氯气通入水中:Cl2+H2O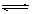 2H++Cl-+ClO- 2H++Cl-+ClO- |
| C.AlCl3溶液中加入足量的氨水:Al3++ 3NH3·H2O = Al(OH)3↓+3NH4+ |
| D.硫酸铜与氢氧化钡反应:Ba2++SO42—=BaSO4↓ |
设计下列实验方案鉴别Na2CO3和NaHCO3两种白色粉末,不能达到预期目的的是
| A.分别向等质量的白色粉末中加等体积适量的水,比较固体溶解量的多少 |
| B.分别配成溶液,加入Ca(OH)2溶液,比较是否有沉淀生成 |
| C.分别配成溶液,做焰色反应,观察火焰的颜色 |
| D.分别将等量的白色粉末用右下图装置进行实验,比较澄清石灰水是否变浑浊 |
以下转化能通过一步反应实现的是
| A.Al2O3→Al(OH)3 | B.SiO2 →H2SiO3 | C.Fe→FeCl2 | D.NaCl→NaOH |
用NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.2.4g金属镁变为镁离子时失去的电子数为0.2NA |
| B.1mo1·L-1的A1C13溶液中,C1-离子的数目为3 NA |
| C.标准状况下,11.2LH2O含有的分子数为0.5NA |
| D.常温常压下,32g O2和O3的混合气体所含原子数为2.5NA |