运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);使用催化剂反应的
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);使用催化剂反应的
△H (填“增大”“减小”或“不改变”)
(2)已知:O2 (g) = O2+(g)+e- △H1="1175.7" kJ·mol-1
PtF6(g)+ e- =PtF6-(g) △H2= -771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+ PtF6-(g) △H3="482.2" kJ·mol-1
则反应O2(g)+ PtF6(g)= O2+PtF6-(s)的△H="__________" kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E、B与G、D与L分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上八种元素中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式)_________,E、F、L所形成的简单离子的半径由大到小的顺序为(用离子符号表示)____ >> 。
(2)由L、I两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为。固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:。
(3)在10 L的密闭容器中,通入2mol LD2气体和1 mol D2气体,一定温度下反应后生成LD3气体,当反应达到平衡时,D2的浓度为0.01 mol·L-1,同时放出约177 kJ的热量,则平衡时LD2的转化率为;该反应的热化学方程式为;此时该反应的平衡常数K=。
(4)有人设想寻求合适的催化剂和电极材料,以C2、A2为电极反应物,以HCl一NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极反应式;放电时溶液中H+移向(填“正”或“负”)极。
Na与S反应可以生成多种产物:Na2S,Na2S2……Na2S5。已知Na2S2的电子式为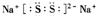 则S32-的电子式为。已知Na2S3+2HCl = 2NaCl+H2S↑+2S↓,试写出Na2S5与醋酸反应的离子方程式:。工业上常用电解熔融NaCl制Na,事实上电解许多熔融的钠的化合物也能制备Na,如NaOH、Na2CO3。试写出电解熔融NaOH的反应方程式:,若电解熔融Na2CO3时有CO2气体产生,则阳极电极反应式为。
则S32-的电子式为。已知Na2S3+2HCl = 2NaCl+H2S↑+2S↓,试写出Na2S5与醋酸反应的离子方程式:。工业上常用电解熔融NaCl制Na,事实上电解许多熔融的钠的化合物也能制备Na,如NaOH、Na2CO3。试写出电解熔融NaOH的反应方程式:,若电解熔融Na2CO3时有CO2气体产生,则阳极电极反应式为。
在CS2溶剂中,加入碘和过量的白磷(P4)反应,只生成四碘化二磷。反应后蒸出CS2,固体物质为四碘化二磷和过量的P4,加入适量水到固体物中反应,生成磷酸和一种碘化物A,A中阳离子为正四面体构型,A中既含有离子键,也有共价键,还有配位键。写出四碘化二磷、P4和水反应的化学方程式________________________________,四碘化二磷的磷的化合价为________,磷酸中磷的化合价为____________________,A中磷的化合价为____________________。
由短周期元素组成的A、B两种盐可发生变化,且B的焰色反应呈黄色(图中其他生成物未列出)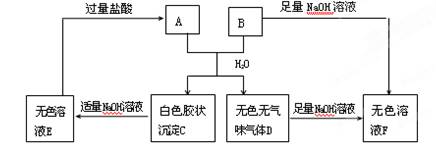
(1)无色溶液F中,一定含有的溶质的化学式为。
(2)写出白色胶状沉淀C转化为无色溶液E的离子方程式________________________。
(3)A和B的混合物溶于水发生反应的离子方程式____________________________。
(4)B、E两溶液混合反应时,可观察到的现象是__________________________,写出其反应的 离子方程式_________________________________________________________。
离子方程式_________________________________________________________。
(16分)(1)AgNO3的水溶液呈(填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示):
;
实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以(填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈性 ,原因是(用离子方程式表示):__________________
_ _________________________________________________ 。
_________________________________________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的。