(每空2分,共8分)已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种 ,并且互不重复:NH
,并且互不重复:NH 、Ba2+、Na+、H+、SO
、Ba2+、Na+、H+、SO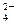 、NO
、NO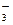 、OH-、CO
、OH-、CO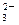 。将这四种溶液分别标记为A、B、C、D,进行如下实验:
。将这四种溶液分别标记为A、B、C、D,进行如下实验:
①在A或D中滴入C,均有沉淀生成
②D和B反应生成的气体能被A吸收
③A和D反应生成的气体能被B吸收
试回答下列问题:
(1)D的化学式是______,判断理由是___________________________________________________________________________。
(2)写出B物质的化学式_____。
(3)写出D和B反应的离子方程式___________________。
某同学欲配制100mL0.20mol,L-1的KCl溶液,实验操作如下:
(A)用托盘天平准确称取1.49gKCl固体,并放入烧杯中;
(B)加入约30mL蒸馏水,用玻璃棒搅拌使其溶解,并恢复至室温;
(C)将KCl溶液由烧杯小心倒入100mL容量瓶中;
(D)然后往容量瓶中加蒸馏水,直到液面接近标线1-2cm处,轻轻摇动容量瓶并静置片刻后,改用胶头滴管滴加蒸馏水;
(E)使溶液凹面最低点恰好与刻度相切,把容量瓶盖好,上下翻转摇匀后装瓶。
(1)该学生操作中错误的是____ _____(填写编号)。
(2)下面哪些操作会导致所配的100mLO.20mol/L的KCl溶液浓度降低_ ___。
(A)容量瓶用蒸馏水洗涤三次直到洗净, (B)称量KCl固体时将砝码放在左盘
(C)未洗涤转移KCl溶液的烧杯, (D)转移KCl溶液时有KCl溶液溅出
(E)定容时仰视刻度线
(3)若用O.2mol,L-1的KCl溶液配制0.05mol,L-1的KCl溶液200.0mL,需要O.20mol,L-1的KCl溶液mL,
(4)已知在标准状况下1L水可以溶解VLHCl气体,此时所形成的溶液密度为ρg/mL,(相对原子质量Cl35.5 H 1),该溶液物质的量浓度为: (mol/L)
某溶液中含有Ba2+、Cu2+、Ag+、Mg2+等四种金属阳离子,现欲将这四种阳离子逐一沉淀下来。某学生设计了如下四种方案。所选试剂及顺序如下:
甲方案:Na2SO4溶液、稀盐酸、H2S、NaOH溶液
乙方案:稀盐酸、Na2SO4溶液、H2S、NaOH溶液
丙方案:NaCl溶液、Na2SO4溶液、NaOH溶液、Na2S溶液
丁方案:Na2S溶液、Na2SO4溶液、NaCl溶液、NaOH溶液
试回答:
(1) 你认为可行的方案是__________方案,反应的离子方程式有:__________________。
(2)方案__________不可行的原因是:________________________________________。
方案__________不可行的原因是:________________________________________。
方案__________不可行的原因是:________________________________________。
以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。
实验用品:硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、玻璃棒、药匙、托盘天平
实验步骤:
① 准确称量一个干净、干燥的坩埚;
② 在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量的试样放入研钵中研细,再放回到坩埚中;
③ 将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④ 将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤ 将步骤④中的坩埚 再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
⑥ 根据实验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是;
(2)指出实验步骤中存在的错误并改正:;
(3)硫酸钠不能放置在空气中冷却的原因是;
(4)步骤⑤的目的是;
(5)下面的情况有可能造成测试结果偏高的是(填序号)。
| A.试样中含有加热不挥发的杂质 | B.试样中含有加热易挥发的杂质 |
| C.测试前试样已有部分脱水 | D.实验前坩埚未完全干燥 |
E.晶体加热脱水不完全 F.加热时有晶体溅出
某溶液中含有Ba2+、Cu2+、Ag+、Mg2+等四种金属阳离子,现欲将这四种阳离子逐一沉淀下来。某学生设计了如下四种方案。所选试剂及顺序如下:
甲方案:Na2SO4溶液、稀盐酸、H2S、NaOH溶液
乙方案:稀盐酸、Na2SO4溶液、H2S、NaOH溶液
丙方案:NaCl溶液、Na2SO4溶液、NaOH溶液、Na2S溶液
丁方案:Na2S溶液、Na2SO4溶液、NaCl溶液、NaOH溶液
试回答:
(1) 你认为可行的方案是__________方案,反应的离子方程式有:__________________。
(2)方案__________不可行的原因是:________________________________________。
方案__________不可行的原因是:________________________________________。
方案__________不可行的原因是:________________________________________。
以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。
实验用品:硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、玻璃棒、药匙、托盘天平
实验步骤:
① 准确称量一个干净、干燥的坩埚;
② 在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量的试样放入研钵中研细,再放回到坩埚中;
③ 将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④ 将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤ 将步骤④中的坩埚 再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
⑥ 根据实验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是 ;
(2)指出实验步骤中存在的错误并改正: ;
(3)硫酸钠不能放置在空气中冷却的原因是 ;
(4)步骤⑤的目的是 ;
(5)下面的情况有可能造成测试结果偏高的是 (填序号)。
| A.试样中含有加热不挥发的杂质 | B.试样中含有加热易挥发的杂质 |
| C.测试前试样已有部分脱水 | D.实验前坩埚未完全干燥 |
E.晶体加热脱水不完全 F.加热时有晶体溅出