(每空2分,共8分)某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应 物或生成物已略去):
物或生成物已略去):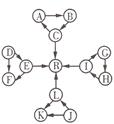
已知:①图中每个小三角形的三种物质中至少含有一种相同元素,K与L含有完全相同的元素;②D、J为固体单质,R为气体单质,其余物质为常见化合物;③A能使品红溶液褪色,也能使澄清石灰变浑浊,C的浓溶液与固体J在加热条件下反应生成A、L以及水;④E为淡黄色化合物,E与L或水反应都能生成R;⑤I为氧化物,I与F或C都 能反应;G和L反应生成白色胶状沉淀H,H具有较强的吸附性。根据以上信息,
能反应;G和L反应生成白色胶状沉淀H,H具有较强的吸附性。根据以上信息, 回答下列问题:
回答下列问题:
(1)写出下列反应的化学方程式:
①D→F:________________________________。
②L→R:________________________________。
( 2)写出下列反应的离子方程式:
2)写出下列反应的离子方程式:
①G中通入过量CO2:__________________________。
②I→G:________________________________。
利用反应Cu+2FeCl3===CuCl2+2FeCl2组成一个化学电池。
(1)指出正极为________,电极反应式为__________________________________;负极为____________,电极反应式为____________________________。
(2)若电池内溶液为100 mL 0.5 mol/L的FeCl3溶液;当溶液中FeCl3全部被还原成FeCl2时,溶液中CuCl2的物质的量浓度是________,导线上通过的电子是________mol。
按如图所示进行铁腐蚀的实验,一周后观察:
(1)若试管中液面上升,发生的是________腐蚀,电极反应为:
正极_________________________________________________________;
负极___________________________________________________________。
(2)若试管中液面下降,发生的是____________腐蚀,电极反应为:正极
________________________________________________________________________;
负极________________________________________________________________________。
某学校设计了一节实验活动课,让学生从废旧电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下。回答有关问题。
(1)干电池的基本构造和工作原理如图为干电池的基本构造图。干电池工作时负极上的电极反应是__________________________,MnO2的作用是除去正极上的产物H2,该反应方程式为2MnO2+H2=Mn2O3+H2O。
(2)锌皮和碳棒的回收用钳子和剪子剪开待回收的干电池的锌筒,将锌皮和碳棒取出,并用毛刷刷干净,将电池内的黑色粉末移入烧杯中。
(3)氯化铵、氯化锌的提取、检验和分离
①如何从黑色粉末中提取NH4Cl和ZnCl2等晶体的混合物?写出简要的实验步骤________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
②设计简单的实验证明所得晶体中含有NH。
实验步骤
________________________________________________________________________
________________________________________________________________________;
实验现象
________________________________________________________________________;
有关的离子方程式
________________________________________________________________________。
③用________的方法可将NH4Cl和ZnCl2的晶体混合物分离开。
④最后剩余的黑色残渣的主要成分是MnO2,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中要用到的主要仪器有
________________________________________________________________________。
为节省药品和时间,甲、乙、丙三位同学用铜片、锌片、稀硫酸、CuSO4溶液;直流电源、石墨电极、导线、烧杯、试管等中学化学常见的药品和仪器(用品),以巧妙的构思,“接力”的方式,设计了比较铜与锌金属活泼性相对强弱的系列实验。试填写下列空白:
(1)甲同学分别将一小片铜片、锌片置于烧杯底部(铜、锌不接触),小心向烧杯中加入稀硫酸,观察到的现象是______________________________。甲同学的设计思路是________________________________________________________________________。
(2)乙同学接着甲的实验,向烧杯中滴加________溶液,进而观察到的现象是________________________________________________________________________,
________________________。乙同学判断出锌、铜金属活动性相对强弱所依据的原理是________________________________________________________________________
________________________________________________________________________,
________________________________________________________________________。
(3)丙同学使用直流电源和石墨电极组装电解装置,向乙同学实验后的溶液中补充了必要的试剂(作电解液)。反
应在调控下开始,有关电化学反应的化学方程式为______________________________。获得的明显实验现象是
________________________________________________________________________
________________________________________________________________________。
(4)请你再单独设计一个简单实验(试剂、仪器自选),证实锌和铜金属活泼性的相对强弱(简要说明操作步骤及现象)____________________________________
________________________________________________________________________
________________________________________________________________________。
现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积约6 mL和检验氯气的氧化性(不应将多余的氯气排入空气中)。
(1)试从上图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是:A接__________,B接__________;
(2)碳棒接直流电源的________极,电极反应式为
________________________________________________________________________
________________________________________________________________________;
(3)能说明氯气具有氧化性的实验现象是
________________________________________________________________________
________________________________________________________________________;
(4)假定装入U形管的饱和食盐水为50 mL(电解前后溶液的体积变化可忽略),当测得生成的氢气为5.6 mL(标准状况)时停止通电。摇匀U形管内的溶液后溶液的pH约为________;
(5)用离子方程式表示电解饱和食盐水的总反应:
________________________________________________________________________
________________________________________________________________________;
氯气与NaOH溶液反应的离子方程式:
________________________________________________________________________
________________________________________________________________________。