【原创】某小组的同学想利用原电池的反应检测金属的活动性顺序,使用镁片和铝片,可选用的溶液有2mol/L的硫酸,2mol/L的氢氧化钠,和10.0 mol/L的浓硝酸。甲、乙、丙三名同学分别设计如下装置。
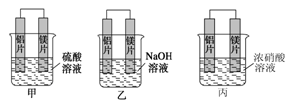
(1)甲中_____________做负极,正极的电极反应式为________________。
(2)乙中__________做负极,丙中______做正极。乙中总反应的离子方程式为________。
(3)如果甲和乙同学都认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出______活动性更强,而乙会判断出_______活动性更强。(填元素符号)。
(4)由此实验,可得到如下哪些正确的结论( )
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 |
| B.该实验说明金属活动性顺序表已经过时,没有使用价值 |
| C.镁的金属性不一定比铝强 |
| D.实验说明化学研究需要具体问题具体分析 |
某研究性学习小组在实验室合成了一种物质A。
(1)已知:A的相对分子质量不超过100,4.3g A在氧气中完全燃烧,生成的气体通过浓硫酸,浓硫酸增重4.5g;剩余气体通过碱石灰,碱石灰增重11.0g则A的分子式为
(2)该兴趣小组同学对物质A结构进行了预测,其中不正确的是(填序号)
A.可能含有一个碳环和一个醛基
B.可能含有一个碳碳双键和一个羟基
C.可能只含一个碳氧双键官能团
D.可能是环状的醚
(3)若A的核磁共振氢谱如下图所示,且A可以和金属钠反应生成H2,但不能在Cu作催化剂下被催化氧化。(提示:羟基与碳碳双键相连的结构不稳定)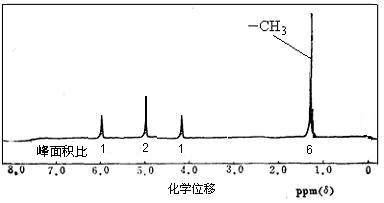
请根据以上信息写出A的结构简式。
(4)已知 “C=C=C”的结构是不稳定的,A 在一定条件下发生消去反应可以生成天然橡胶的单体,写出该反应的化学方程式(并注明条件)
在一定条件下发生消去反应可以生成天然橡胶的单体,写出该反应的化学方程式(并注明条件)
。
塑料是日常生活中常用的高分子合成材料,常用塑料F、G均可由某烃经下列反应得到: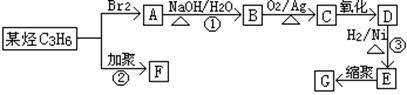
(1)写出反应①、③的反应类型:、。
(2)写出C3H6的同分异构体的结构简式:;B和D都易溶于水,提供一种试
剂加以鉴别,试剂名称为。
(3)写出反应②的化学方程式:。
(4)写出用新制氢氧化铜悬浊液完成C→D反应的化学方程式:。
(5)写出高分子化合物G的结构简式
(5分) 常温下,有浓度均为0.5mol/L的四种溶液:①Na2CO3②NaHCO3③HCl ④NH3・H2O
(1)上述溶液中,可发生水解的是(填序号)。
(2)向溶液④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值(填增大、减小或不变)。
(3)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积④的体积(填“>”、“=”或“<”),此时溶液中离子浓度由大到小的顺序是。
(4)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+ )=。
)=。
(7分)
(Ⅰ)CuCl2溶液有时呈黄色,有时呈绿色或蓝色,这是因为CuCl2溶液中存在平衡:
[Cu(H2O)2]2++4Cl- [CuCl4]2-+4H2O。试回答下列问题:
[CuCl4]2-+4H2O。试回答下列问题:
(蓝色)(黄色)
(1)欲使溶液由蓝色变为黄色,可采取的措施是。
(2)欲使溶液由黄色变为蓝色(或黄绿色),可采取的措施是或。
(Ⅱ)有下列5种有机化合物,请按要求填空:
(1)属于酯类的是(填编号,下同);可归类于酚类的是。
(2)既能与NaOH溶液反应,又能与HCl溶液反应的是。
(3)用系统命名法给B物质命名。
一氧化碳与水蒸气的反应为CO(g) + H2O(g)  CO2(g) + H2(g)在密闭容器中,将1.0 mol CO与1.0mol H2O混合加热到434℃,在434℃的平衡常数K1 =9
CO2(g) + H2(g)在密闭容器中,将1.0 mol CO与1.0mol H2O混合加热到434℃,在434℃的平衡常数K1 =9
(1)跟踪测定H2O的物质的量浓度,如图所示,则0 —20 min ,H2O的反应速率是
(2)请在图中用实线绘制出在该温度下加入正催化剂后,H2O的物质的量浓度变化图线。
(3)从434℃升温至800℃,800℃的平衡常数K2 =1,则正反应为_____________(填“放
热反应”或“吸热反应”或“不能确定”)。
(4)求在800℃反应达平衡时,CO转化为CO2的转化率(写出必要的计算过程)