【化学——物质结构与性质】选做X、Y、Z、L四种元素分别位于周期表中三个紧邻的周期且原子序数依次增大,它们相关信息如下:
X元素原子的价电子构型为nsnnp2n,Y和Z位于同一周期,最外层都有两个未成对电子L元素原子的基态未成对电子数是同周期最多的元素。
请回答如下问题:
(1)L元素在周期表中的位置是 。该原子核外电子排布式是 。其最高正价氧化物对应的水化物的化学式是 和 。
(2)元素X与Y形成的化合物晶体类型是 晶体,1mol该化合物含有的化学键数目为 (用阿伏加德罗常数NA表示)
(3)元素M是周期表中电负性最强的元素,X与M形成的化合物XM2的分子几何构型是 ,该化合物中X原子的杂化轨道类型是 。
(4)X与碳、氢三种元素形成的相对分子质量最小的分子里有 个σ键, 个π键
(5)金属元素N与Z形成的离子化合物的晶胞结构如图,晶胞中Z离子数目为 。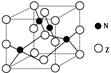
向盛有5 mL 0.005 mol/L FeCl3溶液的试管中加入5 mL 0.01 mol/L KSCN溶液,溶液呈红色。将上述溶液均分置于甲、乙两支试管中,向甲试管中加入4滴饱和FeCl3溶液,向乙试管中加入4滴浓KSCN溶液,充分振荡,观察溶液颜色变化。然后再分别向上述两支试管中滴加5滴0.5 mol/L NaOH溶液,观察现象并回答下列问题。
⑴向两支试管中分别加入饱和FeCl3溶液和浓KSCN溶液后,均可观察到的现象是__________________________________。
⑵产生上述现象后,向两支试管中滴加NaOH溶液,均可观察到的现象是_________
______________,产生该现象的原因是___________________________________。
⑶滴加NaOH溶液后,除观察到⑵中所述现象外,还会看到一支试管中有沉淀生成,另一支试管中几乎没有。有沉淀生成的试管是_________(填“甲”或“乙”)。
某种溶液仅含下表离子中的5种(不考虑水的电离与离子的水解),且各种离子的物质的量均为1mol。
| 阳离子 |
K+、Ba2+、Fe2+、Al3+、Fe3+、Mg2+ |
| 阴离子 |
OH—、HCO3—、CO32—、Cl—、NO3—、SO42— |
若向原溶液中加入足量的盐酸,有气体生成。经分析知:反应后的溶液中的阴离子的种类没有变化。
(1)溶液中(填“一定”、“一定不”、“可能”)含有HCO3—或CO32—,理由是。
(2)原溶液中所含的阴离子有,阳离子有。(填离子的符号)
(3)向原溶液中加入足量的盐酸,生成无色气体的离子反应方程式:;
(4)若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧至恒重,则得到固体的质量为g。
有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A原子核内无中子;A和E、D和F分别同主族,且B与D 最外层电子数之比为2:3。试回答下列问题:
(1)A元素的名称是 ,E元素在周期表中的位置是 ;
(2)C、D、F的气态氢化物稳定性由强到弱的顺序是 (填化学式);
(3)E单质在足量D单质中燃烧生成的化合物的电子式是 ;
(4)化合物X、Y均由A、D、E、F四种元素组成。
①X、Y均属于 晶体;
②X与Y的水溶液相混合发生反应的离子方程式为 ;
(5)向化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成。其离子反应方程式为: ;
(6)若由A、 C组成的简单氢化物燃烧生成无污染物,燃烧热为aKJ/mol,请写出表示该简单氢化物燃烧热的热化学方程式 。
(15分)回答下列问题。
(1) 漂白粉与浓盐酸相遇时有黄绿色气体生成,若产生气体在标准状况下的体积为11.2L,则有molHCl被氧化。
(2) 向氯水中加入CaCO3固体后,氯水的杀菌、漂白能力将(填增强或减弱)其原因是。
(3)二氧化硫气体与含1.5 mol Cl元素的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种气态氯氧化物A,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是: 。
(4)我国卫生部已明确提出:要逐步用氯的氧化物A替代氯气进行饮用水的消毒。
①氯的氧化物A不稳定,可与NaOH溶液、H2O2反应,Cl元素转化为比较稳定的正三价物质,该反应的化学方程式为。
② 用氯的氧化物A处理过的自来水中会残留少量A,可用FeCl2将其还原为 。现用VL(已换算为标准状况) A处理一定量自来水,再加入a mol FeCl2可将残留的A恰好除去,则该自来水中残留A的物质的量为。
。现用VL(已换算为标准状况) A处理一定量自来水,再加入a mol FeCl2可将残留的A恰好除去,则该自来水中残留A的物质的量为。
下表为元素周期表的一部分,请参照元素①—⑩在表中的位置,
回答下列问题:
 族 族周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
(1) ⑩的离子结构示意图为 。
(2)④⑤⑥⑨⑩的离子半径由大到小的顺序为______________(用离子符号表示)。
(3)④的氢化物沸点比⑨高,说明理由____________________________。
(4)上述元素构成的两个不同的10电子微粒,能反应生成两个相同的10电子微粒。写出二者反应的方程式为________________。
(5)由④⑤两种元素组成的一种化合物加入到硫酸亚铁溶液中,立即产生红褐色沉淀,但无气体产生,该化合物的电子式,该反应的离子方程式______。