下表为元素周期表的一部分,请参照元素①—⑩在表中的位置,
回答下列问题:
 族 族周期 |
IA |
|
|
|
|
|
|
0 |
| 1 |
① |
ⅡA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
| 2 |
|
|
|
② |
③ |
④ |
|
|
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
|
⑨ |
⑩ |
|
(1) ⑩的离子结构示意图为 。
(2)④⑤⑥⑨⑩的离子半径由大到小的顺序为______________(用离子符号表示)。
(3)④的氢化物沸点比⑨高,说明理由____________________________。
(4)上述元素构成的两个不同的10电子微粒,能反应生成两个相同的10电子微粒。写出二者反应的方程式为________ ________。
(5)由④⑤两种元素组成的一种化合物加入到硫酸亚铁溶液中,立即产生红褐色沉淀,但无气体产生,该化合物的电子式 ,该反应的离子方程式___ ___。
I.按要求写出对应反应的离子方程式:
(1)硫酸镁溶液与氢氧化钡溶液反应 ;
(2)用氢氧化钠溶液出去CO中少量的 CO2气 ;
(3)用稀硫酸除去铁钉上的铁锈(主要成分是Fe2O3) ;
II.以下8种为中学化学中常见的物质:
①CaO ②H2O ③胆矾 ④CaCO3 ⑤H2SO4 ⑥氨水 ⑦酒精 ⑧Cu
请按下列分类标准回答问题:
(1)属于电解质的是 (2)属于盐的是
(3)属于氧化物的是 (4)属于非电解质的是
现有25℃时0.1mol•L-1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,一水合氨的电离平衡___________移动(填“向左”、“向右”或“不”);此时溶液中C(OH-)/C(NH3·H2O)___________(填“增大”、“减小”或“不变”)。
(2)若向氨水中加入稀硫酸至溶液的pH=7,此时C(NH4+)="a" mol•L-1,则C(SO42-)=_______________。
(3)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:__________________;所得溶液的pH___________7(填“>”、“<”或“=”),用离子方程式表示其原因______________,所得溶液中各离子的物质的量浓度由大到小的顺是______________________。
甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+ H2O(g) ΔH2
CH3OH(g)+ H2O(g) ΔH2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
| 温度 |
250 ℃ |
300 ℃ |
350 ℃ |
| K |
2.0 |
0.27 |
0.012 |
(1)在一定条件下将2 mol CO和6 mol H2充入2 L的密闭容器中发生反应Ⅰ,5 min后测得c(CO)="0.4" mol/L,计算可得此段时间的反应速率(用H2表示)为 mol/(L·min)。
(2)由表中数据判断ΔH1 0(填“>”、“<”或“=”);反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH3= (用ΔH1和ΔH2表示)。
CO(g)+H2O(g) ΔH3= (用ΔH1和ΔH2表示)。
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是 (填字母序号)。
A.充入CO,使体系总压强增大 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大D.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:KⅡ= ;保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡 移动(填“正向”、“逆向”或“不”),平衡常数KⅡ (填“变大”、“变小”或“不变”)。
在一定温度下,将冰醋酸加水稀释的过程中,溶液的导电能力I随加入水的体积V变化的曲线如下图所示。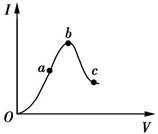
请回答下列问题:
(1)“O”点冰醋酸不能导电的原因是_____________。
(2)a、b、c三点对应的溶液中,C(H+)由小到大的顺序为 。(填字母,后同)
(3)a、b、c三点对应的溶液中,CH3COOH的电离程度最大的是 。
(4) a、b、c三点对应的溶液中,水的电离程度最大的是 。
(5)若使c点对应的溶液中的c(CH3COO-)增大,在下列措施中,可行的是 (填字母,后同)。
A.加热 B.加KOH固体
C.加水 D.加CH3COONa固体
E.加锌粒
(6)在稀释过程中,随着醋酸浓度的降低,下列各量始终保持增大趋势的是 。
A. C(H+) B.H+物质的量 C. C(OH-) D.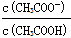
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 |
K+ Na+ Cu2+ Al3+ |
| 阴离子 |
SO42﹣ HCO3﹣ NO3﹣ OH﹣ |
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B ,D .
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 .
(3)在A溶液中加少入量澄清石灰水,其离子方程式为 .
(4)C常用作净水剂,用离子方程式表示其净水原理 .