()用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g)⇋1/4CaS(s)+CO2(g),∆H1=-47.3kJ∙mol-1
②CaSO4(s)+CO(g)⇋CaO(s)+CO2(g) +SO2(g),∆H2=+210.5kJ∙mol-1
③CO(g)⇋1/2C(s)+1/2CO2(g),∆H3=-86.2kJ∙mol-1
(1)反应2CaSO4(s)+7CO(g)⇋CaS(s)+ CaO(s)+6CO2(g)+ C(s) +SO2(g)的∆H=___________(用∆H1、∆H2和∆H3表示)
(2)反应①-③的平衡常数的对数lgK随反应温度T的变化曲线见图,
结合各反应的∆H,归纳lgK-T曲线变化规律:
a)____________________________;
b)____________________________。
(3)向盛有CaSO4的真空恒容密闭容器中充入CO,反应①于900℃达到平衡,c平衡(CO)=8.0X10-5 mol∙L-1,计算CO的转化率(忽略副反应,结果保留两位有效数字)。
(4)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入_______。
(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生CaSO4,该反应的化学方程式为_______________;在一定条件下,CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为___________。
利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O=C O+3H2。部分物质的燃烧热数据如下表:
O+3H2。部分物质的燃烧热数据如下表:
| 物质 |
燃烧热(kJ·mol-1) |
| H2(g) |
-285.8 |
| CO(g) |
-283.0 |
| CH4(g) |
-890.3 |
已知1 mol H2O(g)转变为1 mol H2O(l)时放出4 4.0 kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式
4.0 kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式 。
。
(2)500℃、50MPa时,在容积为V L的容器中加入1 mol N2、3 mol H2,,此时N2的转化率为a。则平衡时NH3的浓度为。
(3)1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下:
某化工厂已购得乙烯11.2 t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2O CO+H2 CH4+H2O
CO+H2 CH4+H2O CO+3H2
CO+3H2
假设在生产过程中,反应①、②、③中各有机物的转化率均为100%。且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭吨、甲烷吨,
才能满足生产需要。
已知D、M、H是常见的非金属单质,其中M是无色气体,H是有色气体,J是一种金属单质(其同族的某种元素是形成化合物种类最多的元素),A、C是金属氧化物,C和J均是某种常见电池的电极材料,J元素的+2价化合物比+4价化合物稳定,B与C反应时,每生成1molH同时消耗4molB和1molC,K只知含有CO或CO2中的一种或两种。它们关系如图: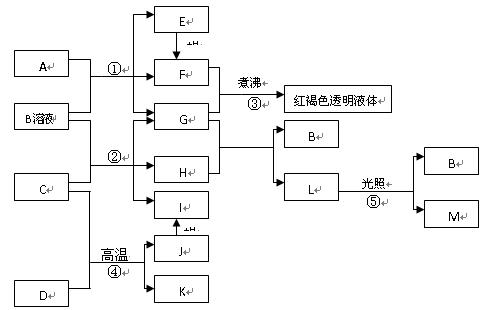
(1)写出下列物质的化学式: AD
(2)写出下列反应的化学方程式:
②
⑤
(3)由金属氧化物A和C得到其相应的金属,在冶金工业上一般可用方法(填序号)
①热分解法②热还原法③电解法
其中从A得到其相应金属也可用铝热法,若反应中1molA参加反应,转移电子的物质的量为
(4)用C、J作电极,与硫酸构成如图所示电池,正极的电极反应为
当反应转移1mol电子时,负极质量增加g。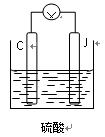
已知元素的电负性是分子内一个原子吸引电子的能力,能力越大,电负性越大,非金属性越强。电负性和原子半径一样,也是元素的一种基本性质,下面给出14种元素的电负性:
| 元素 |
Li |
Be |
B |
C |
N |
O |
F |
| 电负性 |
0.98 |
1.57 |
2.04 |
2.55 |
3.04 |
3.44 |
3.98 |
| 元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
| 电负性 |
0.93 |
1.31 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
请结合元素周期律知识完成下列问题:
(1)根据上表给出的数据,可推知元素的电负性具有的变化规律是
(2)预测下列两组元素电负性的大小关系:KCa ,NaK(填“大于”、“小于”或者“等于”)。
.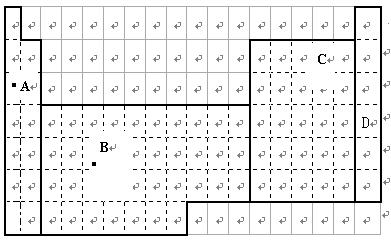
(1)在上面元素周期表中全部是金属元素的区域为。
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是(填名称),可以验证该结论的实验是。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
.A、B、C、D、E为短周期元素,在周期表中所处的位置如下图所示。A、C两种元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等:
| A |
C |
|
| D |
B |
E |
(1)写出三种元素名称A、B 、C。
(2)B元素位于元素周期表中第周期,族。
(3)比较B、D、E三种元素的最高价氧化物的水化物酸(碱)性最强的是(用化学式表示);E和Na 形成的化合物的电子式是。