在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
| 化学方程式 |
K(t1) |
K(t2) |
F2+H2 2HF 2HF |
1.8×1036 |
1.9×1032 |
Cl2+H2 2HCl 2HCl |
9.7×1012 |
4.2×1011 |
Br2+H2 2HBr 2HBr |
5.6×107 |
9.3×106 |
I2+H2 2HI 2HI |
43 |
34 |
(1)已知t2>t1,HX的生成反应是________反应(填“吸热”或“放热”).
(2)HX的电子式是________.
(3)共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是________.
(4)X2都能与H2反应生成HX,用原子结构解释原因:_________________________________________.
(5)K的变化体现出X2化学性质的递变性,用原子结构解释原因:_______________________________,原子半径逐渐增大,得电子能力逐渐减弱.
(6)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,________(选填字母).
a.在相同条件下,平衡时X2的转化率逐渐降低
b.X2与H2反应的剧烈程度逐渐减弱
c.HX的还原性逐渐减弱
d.HX的稳定性逐渐减弱
为了达到下列表格中的实验要求,请从供选择的化学试剂中选出合适的试剂,将其标号填入对应的空格中。
下图中A~G均为中学化学中常见的物质,它们之间有如下转化关系。常温下,A为紫红色金属固体,B为常见的强酸,G为地壳中含量最多元素组成的气态单质;D、F都是大气污染物,主要来源于汽车尾气,D为无色气体,F为红棕色气体。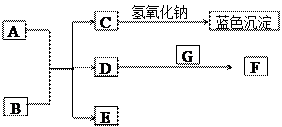
请回答以下问题:
①D的化学式是;C+NaOH生成的蓝色沉淀是(填化学式);
②构成G单质的元素在元素周期表中的位置为;
③写出B的稀溶液与A反应的化学方程式:。
下面是元素周期表的一部分,表中的每个字母表示一种短周期元素,请回答下列问题:
| A |
||||||||
| B |
C |
D |
E |
(1)D的最高价氧化物对应的水化物的化学式是__________。
(2)A、E两种元素中非金属较强的是___________(填元素符号)。
(3)B、C两元素的原子半径较小的是___________(填元素符号)。
(4)在盛有水的小烧杯中加入元素B的单质,发生反应的化学方程式为:
_________________________________________________________________________。
请根据题意选择下列物质:
| A.CH3COOH, | B.CH3CH2OH, | C.NaHCO3, | D.Na2O2,并用其字母代号填空: |
(l)能和碳酸钠反应生成二氧化碳的是;
(2)常用作为潜水艇呼吸面具中氧气来源的是;
(3)常用作溶剂,也可用作汽油替代燃料的是。
乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成。乙醇和汽油经加工处理形成的车用燃料即乙醇汽油。
结合有关知识,回答下列问题:
(1)乙醇分子中的官能团是(填写名称)。
(2)试写出实验室用乙酸和乙醇在浓硫酸催化作用下共热反应生成乙酸乙酯的化学方程式 。