锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(a)所示。
回答下列问题:
(1)普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是________,电解质的主要成分是______,正极发生的主要反应是_______。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是_______。
(2)图(b)表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
(3)图(b)中产物的化学式分别为A_______,B________。
①操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为_______。
②采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是________。(填化学式)
分子式为C12H14O2的F有机物广泛用于香精的调香剂。为了合成该物质,某实验室的科技人员设计了下列合成路线: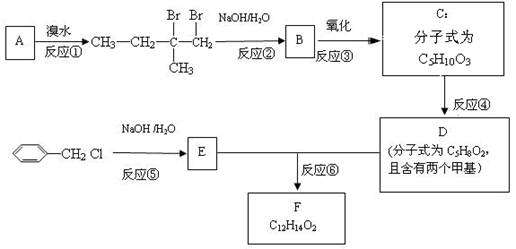
试回答下列问题:
(1)A物质在核磁共振氢谱中能呈现种峰;峰面积比为
(2)C物质的官能团名称
(3)上述合成路线中属于取代反应的是(填编号);
(4)写出反应④、⑤、⑥的化学方程式:
④
⑤
⑥
(5)F有多种同分异构体,请写出符合下列条件的所有结构简式:①属于芳香族化合物,且含有与F相同的官能团;②苯环上有两个取代基,且苯环上的一氯代物只有两种;③其中一个取代基为-CH2COOCH3;
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2 =" 1451" kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
⑴已知BA5为离子化合物,写出其电子式.
⑵B基态原子中能量最高的电子,其电子云在空间有个方向,原子轨道呈形
⑶某同学根据上述信息,推断C基态原子的核外电子排布为:
该同学所画的电子排布图违背了.
⑷G位于族区,价电子排布式为.
⑸DE3 中心原子的杂化方式为,用价层电子对互斥理论推测其空间构型为.
⑹检验F元素的方法是,请用原子结构的知识解释产生此现象的原因是.
⑺若某单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为,该单质晶体中原子的堆积方式为四种基本模式中的.
高纯硅是当今科技的核心材料。工业上,用氢气还原四氯化硅制得高纯硅的反应为SiCl4(g)+2H2(g) Si(s)+4HCl(g)。已知SiCl4可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应。SiCl4的物质的量随时间变化情况如下表所示:
Si(s)+4HCl(g)。已知SiCl4可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应。SiCl4的物质的量随时间变化情况如下表所示: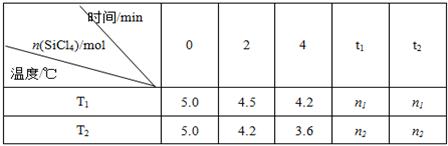
(1)T1时,反应开始的2 min内,用HCl表示的反应速率为。
(2)该反应的平衡常数表达式为:K=。
(3)保持其他条件不变,下列措施可提高SiCl4转化率的是 。
a.充入更多的SiCl4(g)
b.充入更多的H2(g)
c.及时分离出Si(s)
d.使用催化剂
e.将容器的体积扩大一倍
(4)据上表中的数据分析:T1T2(填“>”或“<”,下同),理由是。已知n1>n2,ΔH0。
(5)有同学认为,采用水淋法来吸收生成的HCl,可以提高SiCl4的转化率。该认识(填“合理”或“不合理”),理由是。
(6)将平衡后的混合气体溶于水,取少量上层清液,向其中滴加足量的AgNO3溶液,反应后过滤,取沉淀向其中加入Na2S溶液,可观察到。
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如图所示。
请回答下列问题:
(1)若D为用量最大、用途最广的金属单质,加热蒸干B的溶液没有得到B的盐,则B的化学式可能为。(写出一种即可)
(2)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,则A的电子式为,B的结构式为。
(3)若D为氯碱工业的重要产品,反应(III)的离子方程式为。
(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一,也可作为医疗上治疗胃酸过多症的药剂。
①25℃时,pH均为10的A、B两溶液中,由水电离出的氢氧根离子浓度之比为。
②25℃时,0.1mol·L-1的A、B、C三种溶液,分别用水稀释不同的倍数后,溶液的pH相同,则稀释后溶液的物质的量浓度最大的是溶液(填溶质的化学式)。
③将等物质的量的B和C溶于水形成混合溶液,溶液中各种离子浓度由大到小顺序为。
下图所示物质(部分产物和反应条件未标出)中,只有A是单质,常温下B和 C呈气态,且B是导致酸雨的大气污染物,W是淡黄色固体。
据此回答下列问题:
(1)物质W中所含有的化学键类型为_________,其阴、阳离子个数比为_________。
(2)物质C的结构式为____________。
(3)上图反应中不属于氧化还原反应的有______________(填写序号)。
(4)写出A和X反应的化学方程式_____________;若生成的B在标准状况下的体积为 22.4L,则反应中转移电子数目为_____________。
(5)请写出C和W反应的化学方程式:_______________。
(6)请写出X和Y反应的离子方程式:_________________。