合成氨工业的部分工艺流程如下图所示: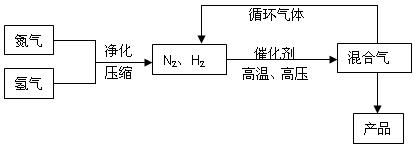
请你回答下列问题:
(1)已知:N2(g)+O2(g) =2NO(g);△H=180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=–905kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ;△H=–483.6kJ·mol-1
则N2(g)+3H2(g)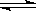 2NH3(g)的△H=_________________。
2NH3(g)的△H=_________________。
(2)改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是_________。
| A.增大压强 | B.降低温度 | C.使用催化剂 | D.增大反应物的浓度 |
(3)在一定条件下,将2molN2与5molH2混合于一个10L的密闭容器中,反应情况如右图所示:
①求5min内的平均反应速率v(NH3)=_______________
②达到平衡时NH3的体积分数为___________%
(4)近年来科学家提出了电解合成氨的方法:采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了高转化率的电解法合成氨(装置如图)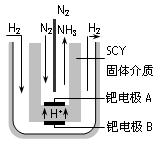
请回答:钯电极A是电解池的_______极(填“阳”或“阴”),该极上的电极反应式是_________________________
有以下物质:
①石墨;②铝;③酒精;④氨水;⑤二氧化碳;⑥碳酸氢钠固体;
⑦氢氧化钡溶液;⑧纯醋酸;⑨氧化钠固体;⑩氯化氢气体。
(1)其中能导电的是 ;属于非电解质的是 ;
属于强电解质的是 ;属于弱电解质的是 。
(2)写出物质⑥溶于水的电离方程式: 。
(3)写出物质⑥和⑧在水中反应的离子方程式: 。
(4)将物质⑥配制成溶液,逐滴加入⑦溶液中至沉淀量最大,写出离子方程式: 。
① 44.8L某气体在标准状况下的质量为142g,该气体的摩尔质量为_________;
② N2在标准状况下的密度为__________g/L;
③在mol AL2(SO4)3中含0.3molSO42—,其中含Al3+个。
①铁片;②饱和食盐水;③液态的纯硫酸;④蔗糖;⑤干冰;⑥熔融硝酸钾;⑦碳酸钙固体;⑧苛性钠;⑨氧化钠。用序号回答:
能导电的是______________,属于电解质的是____________,属于非电解质的是___________________。
按要求填空
①KClO3的电离方程式______________________________
②SO2与足量的NaOH溶液反应_________________________________________
③次氯酸钙溶液中通入少量的CO2气体__________________________________
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);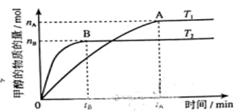
下列说法正确的是________(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为:v(CH3OH)= mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时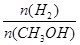 增大
增大
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______;