过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。
请回答下列问题:
(1)用氨水调节pH至8——9的目的是 。
(2)若测得滤液C中c(CO32-)=10-3mol/L,则Ca2+ (填“是”或“否”)沉淀完全。(已知c(Ca2+)≤10-5mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9)
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH4+) c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)。
(4)在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式: ,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9——11,才出现大量沉淀。用化学方程式和简要的文字解释需用氢氧化钠调节pH至9——11的原因 。
已知:①A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2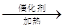 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
回答下列问题:
(1)A、B、C、D中所有原子都在同一平面上的是 。
(2)写出下列反应的反应类型:① ④ 。
(3)B、D的结构简式 ,
结晶玫瑰是一种具有玫瑰香气的香料,可由下列方法合成(部分反应物及反应条件未标出):
请回答下列问题:
(1)已知A是苯的一种同系物,写出A的结构简式 。
(2)C的同分异构体中,属于芳香族化合物的还有 种。
(3)①的反应类型是 。
(4)写出②的化学方程式 。
邻羟基苯甲酸(俗名水杨酸)其结构简式为 :
:
(1)水杨酸既可以看成是__________类物质,同时也可以看成是_____________类物质。
(2)将其与_______________溶液作用生成物的化学式为C7H5O3Na将其与_________溶液作用生成物的化学式为C7H4O3Na2
(3)水杨酸的不同类同分异构体中,属于酚类且也具有苯环的化合物的结构简式为______________,它还可看成是__________类物质。
(4)比水杨酸多一个CH2原子团,且与水杨酸属于同系物的取代基数目不同的两类物质的结构简式分别为__________________、________________
(5)比水杨酸多一个CH2原子团,且与水杨酸不属于同系物的两类物质的结构简式分别为________________
已知柠檬醛的结构简式为:
(1)1mol柠檬醛可与mol溴发生加成反应;
(2)柠檬醛完全加氢后,生成物的名称是;
(3)柠檬醛与新制的Cu(OH)2悬浊液反应的化学方程式是;
(4)若要用实验证明柠檬醛中含有碳碳双键,正确的操作是。
A,B,C三种物质中均含有苯环且分子式都是C7H8O。若滴入FeCl3溶液,只有C呈紫色;若投入金属钠,只有B无变化。
(1)A的结构简式为 ,B的结构简式为 。
(2)C有多种同分异构体,若其一溴代物最多有两种,C的这种同分异构体的结构简式是 。