氯吡格雷(clopidogrel,1)是一种用于抑制血小板聚集的药物,根据原料的不同,该药物的合成路线通常有两条,其中以2氯苯甲醛为原料的合成路线如下: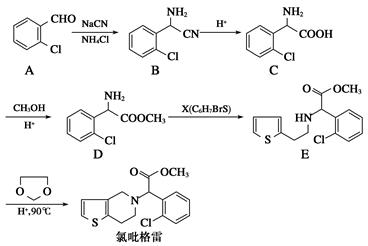
(1)分子D中的官能团名称为________________。X的结构简式为____________。
(2)分子C可在一定条件下反应生成一种产物,该产物分子中含有3个六元环,写出该反应的化学方程式______________________________________
(3)D→E的反应类型是________反应。
(4)写出A属于芳香族化合物的所有同分异构体的结构简式:__________。
(5)已知:CO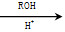 COROH
COROH COROR
COROR
则由乙醇、甲醇为有机原料制备化合物 ,需要经历的反应类型有__________(填写编号)。①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物
,需要经历的反应类型有__________(填写编号)。①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物 的最后一步反应_______________________________________________。
的最后一步反应_______________________________________________。
(3)在下列物质中:①碘②烧碱③NaCl④干冰⑤氯化氢⑥Na2O2。用序号填写下列空白:
(1)既含有离子键又含有非极性键的化合物是;
(2)仅含有离子键的化合物是;
(3)仅含有共价键的单质是。
下列反应属于放热反应的是_ _;属于吸热反应的是____ __
| A.锌粒与稀H2SO4反应制取H2 | B.氢气在氧气中燃烧 |
| C.碳酸钙高温分解成氧化钙和二氧化碳 | D.氢氧化钾和硫酸中和 |
E.Ba(OH)2·8H2O与NH4Cl反应F. C与CO2高温生成CO
G.葡萄糖在人体内氧化分解 H.钢铁制品生锈的反应
(14分)以下几种物质是常用香精的主要成分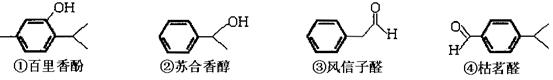 请回答下列问题:
请回答下列问题:
(1)百里香酚和苏合香醇都能发生的有机反应类型有:(填序号)
①取代反应 ②加成反应 ③消去反应 ④氧化反应 ⑤缩聚反应
(2) 写出风信子醛与新制氢氧化铜反应的化学方程式_______________________________________________;
(3)己知醛在一定条件下可以两分子加成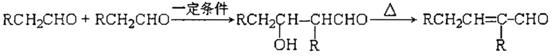
兔耳草醛是重要的合成香料,它具有独特的新鲜水果的清香。由枯茗醛合成兔耳草醛的路线如下: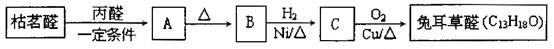
①写出A的结构简式
②设计实验方案检验有机物B中的无氧官能团
③写出C→兔耳草醛的化学方程式
④符合下列条件的A的同分异构体有种。
i.苯环上有两个取代基,其中一个取代基为-CH(CH3)2
ii.能发生水解反应,水解产物之一能与FeCl3溶液发生显色反应。
写出符合上述条件,且核磁共振谱显示有6种氢的结构简式。
Mg及其化合物可以发生如下转化(部分反应物、生成物或水已略去),已知X、Y、Z为气态单质,B常温下为液态,化合物D的焰色反应为黄色,C和G混合冒白烟并生成A,电解E的水溶液常用于某种工业生产。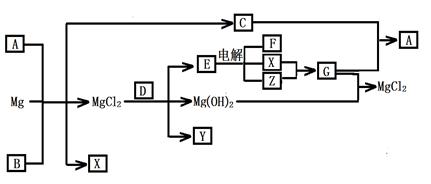
(1)写出下列物质的化学式
AY
(2)写出C的电子式
(3)写出MgCl2与D反应的化学方程式
(4)请用水解平衡理论解释A+B+Mg→C+X+ MgCl2的原因_______________________。
(5)将0.1molCO2通入1L溶质为F的溶液中,充分反应后,再向混合液中逐滴滴加盐酸,所加盐酸的体积与生成的气体的 关系如下图所示:则原F溶液的浓度为mol/L。
关系如下图所示:则原F溶液的浓度为mol/L。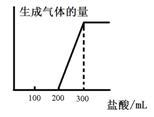
有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A的原子半径最小,B与A能以原子个数1:1、1:2或1:3等组成多种常见化合物;C的最高正价和最低负价的代数和为2;D与F位于同一主族;E与D能以原子个数1:1或2:1形成两种常见化合物.
(1)A与B能形成一种最简单的直线型分子,其电子式为。
(2) CA3极易溶于液态A2D中,其原因 是。
是。
(3)将标准状况下的4.48 L CA3完全溶解在含0.1mol HCl的水溶液中得1L溶液,所得溶液pH=9,其中离子浓度由大到小的顺序是。
(4)物质B2A6D在电解质EDA 的溶液作用下,可形成燃料电池,则该电池的负极反应式为。
的溶液作用下,可形成燃料电池,则该电池的负极反应式为。
(5)E与F形成的化合物属于型化合物(填:离子或共价),用惰性电极电解该化合物的水溶液时,有固体析出,则电解总反应方程式为。