四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑,该反应的氧化剂是 ,当1mol C参与反应时转移 mol电子,请用双线桥描述S+2KNO3+3C=K2S+N2↑+3CO2↑电子转移情况 。

(1)X原子在第二电子层上只有一个空轨道,则X是;其轨道表示式为;R原子的3p轨道上只有一个未成对电子,则R原子可能是、;Y原子的核电荷数为29,其电子排布式是,其在元素周期表中的位置是,是属于区的元素。
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:_________、__________、________。
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子。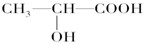
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)________________。
(5) 试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4________H2SO3; H3PO4________H3PO3。
(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为杂化,分子的立体构型为。
BF3分子中,中心原子的杂化方式为杂化,分子的立体构型为。
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于___________________________。
现有下列十种物质:①H2②铝③CuO④CO2⑤H2SO4⑥Ba(OH)2⑦红褐色的氢氧化铁液体⑧氨水⑨稀硝酸
⑩Al2 (SO4)3
(1)按物质的分类方法填写表格的空白处:
| 分类标准 |
氧化物 |
电解质 |
|||
| 属于该类的物质 |
② |
⑧⑨ |
⑦ |
(2)写出⑥⑨的化学反应方程式。
(3)⑩在水中的电离方程式为,17.1g⑩溶于水配成250mL溶液,SO42-的粒子数为,SO42-的物质的量浓度为。
(4)少量的④通入⑥的溶液中反应的化学方程式为。
0.5mol H2SO4的质量是________g,含______________个分子,含________mol氧原子,能和________mol NaOH完全反应,该硫酸所含氢元素的质量与________g HCl中所含氢元素的质量相同。
在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
| 物质 |
A |
B |
C |
| 初始浓度/mol·L-1 |
1.0 |
2.0 |
0 |
| 2min时,平衡浓度/mol·L-1 |
0.4 |
0.2 |
1.2 |
请填写下列空白:
(1)该反应方程式可表示为;反应达平衡时,A的转化率为。
(2)从反应开始到达化学平衡,反应物A的平均反应速率为;25℃时,反应的化学平衡常数K值为_____________。
(3)若已知该反应为放热反应,下图表示由于条件改变而引起反应速度和化学平衡的变化情况:a b过程中改变的条件可能是;b c过程中改变的条件可能是。
(4)如果上述反应起始是按“1molA+3molB”充入,达平衡时C的浓度为a mol/L;维持容器体积和温度不变,按下列方法改变起始物质的量,达到平衡时C的浓度仍为a mol/L的是(填序号):
①2 mol A+6 mol B②2mol C③4mol C④0.5 mol A+1.5mol B+1 mol C
煤化工中常需研究不同温度下的平衡常数、投料比及产率等问题。已知:
CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数随温度的变化如下表:
CO2(g)+H2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
830 |
1000 |
| 平衡常数K |
10 |
9 |
1 |
0.6 |
试回答下列问题:(1)上述反应的正反应是反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率
(填“增大”、“减小”或“不变”),容器内混合气体的压强(填“增大”、“减小”或“不变”)。
(3)830℃,在恒容反应器中发生如表中的反应,按表中的物质的量投入反应混合物,其中向正反应方向进行的有(选填A、B、C、D)。
(4)830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,CO的转化率是。