(12分 )在2L密闭容器中,800℃时反应2NO(g)+O2(g)
)在2L密闭容器中,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)
2NO2(g)体系中,n(NO) 随时间的变化如表:
随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=___________________。
已知:K(300℃)>K(350℃),该反应是________热反应。
(2)图 中表示NO2的变化曲线是____________。用O2表示从0~2s内该反应的平均速率v=___________。
中表示NO2的变化曲线是____________。用O2表示从0~2s内该反应的平均速率v=___________。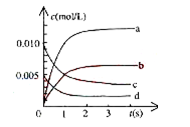
(3)能说明该反应已经达到平衡状态的是___________。
a、v(NO2)=2v(O2) b、容器内压强保持不变
c、v逆(NO)=2v正(O 2) d、容器内的密度保持不变
2) d、容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a、及时分离出NO2气体 b、适当升高温度
c、增大O2的浓度 d、选择高效的催化剂
(14分)下表是元素周期表的一部分,回答有关问题:
| 主族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 二 |
⑴ |
⑵ |
||||||
| 三 |
⑶ |
⑷ |
⑸ |
⑹ |
⑺ |
⑻ |
⑼ |
|
| 四 |
⑽ |
⑾ |
⑿ |
(1)写出下列元素符号:⑴,⑹。
(2)在这些元素中,最不活泼的元素的结构示意图是。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的与呈两性的发生反应的化学方程式为;碱性最强的与呈两性的发生反应的离子方程式为。
(4)在⑵⑶⑻⑽这些元素简单离子中,离子半径由大到小的顺序是(填离子符号)。
(5)元素⑻、⑾和氧元素形成一种广泛使用杀菌消毒剂,该物质中存在的化学键有。
(6)用电子式表示由元素(8)和(10)形成化合物的过程:。
A、B、C、D、E都是短周期元素,原子序数逐渐增大,原子半径按B、A、E、D、C依次增大。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子数多3个。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)D元素在周期表中的位置是__________。
(2)甲物质的电子式是__________。
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中反应的离子方程式是。
(4)用电子式表示A的气态氢化物的形成过程。
有H、C、O、Cl、Na五种元素。
(1)由两种元素组成的四原子离子化合物的电子式__________________,由两种元素组成的三原子共价化合物的电子式______________。(各写1种)
(2)在由三种元素组成的化合物里,其中离子化合物的化学式_____________,共价化合物的化学式______________________。(组成元素不能完全相同)(各写2种)
(7分)常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L HCl溶液和20.00 mL 0.1000 mol/L CH3COOH溶液,得到2条滴定曲线,如下图所示:
(1)由A、C点判断,滴定HCl溶液的曲线是______(填“图1”或“图2”);
(2)a=________ mL;(3)c(Na+)=c(CH3COO-)的点是________
(4)E点对应离子浓度由大到小的顺序为____________________________________。
(5)该温度下CH3COOH的电离常数为_____________________(列式代入数据计算)
(6) 当NaOH溶液滴定CH3COOH溶液过程中,NaOH溶液消耗了10.00 mL时, 则此时混合液中c(CH3COOH)_______ c(CH3COO-)(“>”或“<”或“=”).
(7) t℃时,浓度均为0. 0035mol/L的CH3COONa和NaOH的混合液pH=11,则溶液中c(H+) + c(CH3COO-) +2 c(CH3COOH) =____________(t℃时,Kw =4×10-14 mol2/L2)
(1)Na2CO3俗称纯碱,因CO32-水解而使其水溶液呈碱性,其实质促进了水的电离,水的Kw (“增大”或“减小”或“不变”),试写出CO32-水解的离子方程式 。加水稀释后,pH(“增大”或“减小”或“不变”,下同),c(HCO3-)/c(CO32-) 。
(2)25℃时,某HCl溶液中c(H+)=1×10-4 mol/L,则该溶液中c (OH-)= ,
(3)某温度(t℃)时,测得0.01mol·L-1 ,100ml的NaOH溶液的pH=11,
①则该温度下水的Kw= 。
②加水稀释后pH=10, 则应加入ml的水。(忽略混合后体积的变化,下同)。
③该温度下将pH=2的硫酸和pH=13的氢氧化钠溶液混合后溶液呈中性,则硫酸和氢氧化钠溶液的体积比=_________