下表为元素周期表的一部分,参照元素①~⑧在表中的位置,用化学用语 回答下列问题:
回答下列问题: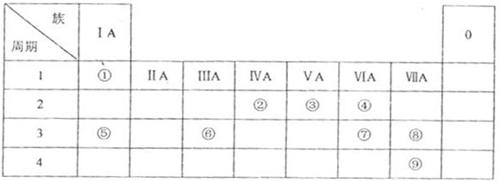
(1)④、⑤、⑦形成的简单离子的半径由大到小的顺序是____________________。
(2)含 ⑦的最高价氧化物对应水化物的稀溶液与足量⑤的最高价氧化物对应水化物的稀溶液反应放出热量
⑦的最高价氧化物对应水化物的稀溶液与足量⑤的最高价氧化物对应水化物的稀溶液反应放出热量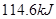 ,此反应的热化学方程式为____________________。
,此反应的热化学方程式为____________________。
(3)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为______________________________。
N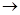 ⑥的单质的化学方程式为________________________________________。
⑥的单质的化学方程式为________________________________________。
M溶液中离子浓度由大到小的顺序为________________________________________。
(4)设计实验探究⑧、⑨两种元素非金属性的相对强弱。
可选用的试剂有:氯水、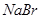 溶液、
溶液、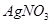 溶液、
溶液、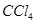 。
。
请完成实验 报告单:
报告单:
| 实验内容 |
现象 |
步骤一:试管1:取少量氯水:试管2:取少量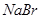 溶液,滴加少量氯水。 溶液,滴加少量氯水。 |
试管2中的现象是:____________________ |
| 步骤二:分别向试管1、试管2中加入试剂________,振荡。 |
试管2中的现象是_________________ |
| ①试管1的作用是________________________________。 ②实验结论是____________________________________________,产生该结论的原因是:同主族元素从上到下________,得电子能力逐渐减弱。 |
化学实验中,同一个装置可以用于不同的实验,例如图的实验装置(B中可为固体或液体,可加热)。
(1)若A中为浓盐酸,B中为高锰酸钾固体,D中为石蕊溶液,则D中现象为________________________。
(2)若A中为足量的浓硝酸,B中为铜单质,D中用NaOH来吸收其产生的气体,请写出D中所发生的反应的化学方程式________________________________________________。
(3)若A中为浓H2SO4,B中为NaCl固体, D中是Na2S与Na2SO3的混合溶液,打开分液漏斗后,加热,D中出现黄色沉淀并有臭鸡蛋气味的气体逸出,则D中n(Na2S)与n(Na2SO3)需满足的条件是______________________________。
(4)该装置可以模拟氨碱法制纯碱,D中为饱和食盐水。先制取________气体通入D中至饱和,再制取_______气体也通入D中,此时可以看到溶液中有晶体析出。请写出该反应的化学方程式___________________________________________________。
(5)利用上述装置,下列实验不可能实现的是_____________________
| A.证明碳酸比苯酚的酸性强 | B.证明氯气的氧化性比溴强 |
| C.用乙醇制备并检验乙烯 | D.制备并收集乙酸乙酯 |
(6)若A中为稀硫酸,B中为碳酸氢钠固体,打开分液漏斗反应一段时间,D中先无现象,后慢慢产生沉淀且不溶解,则D溶液的原溶质可能是______________________________。
氮气与氢气反应生成氨气的平衡常数见下表:
N2+3H2 2NH3 2NH3 |
||||
| 温度 |
25℃ |
200℃ |
400℃ |
600℃ |
| 平衡常数K |
5×108 |
650 |
0.507 |
0.01 |
(1)工业上合成氨的温度一般控制在500℃,原因是。
(2)在2 L密闭容器中加入1 mol氮气和3 mol氢气,进行工业合成氨的模拟实验,若2分钟后,容器内压强为原来的0.8倍,则0到2分钟,氨气的反应速率为________mol/(L·min)。
(3)下列说法能表明该反应达到平衡的是________
A.气体的平均分子量不再变化 B.密闭容器内的压强不再变化
C.v (N2) =" 2" v (NH3) D.气体的密度不再变化
(4)下列措施,既能加快该反应的反应速率,又能增大转化率的是______________
A.使用催化剂 B.缩小容器体积 C.提高反应温度 D.移走NH3
(5)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是______。
A.溶液的pH增大 B.氨水的电离度减小 C.c(OH-)减小 D.c(NH4+)减小
(6)将氨水与盐酸等浓度等体积混合,下列做法能使c(NH4+)与c(Cl-)比值变大的是________
A. 加入固体氯化铵 B.通入少量氯化氢
C. 降低溶液温度 D.加入少量固体氢氧化钠
铁是人类生产和生活中必不可少的重要金属。
(1)自然界一共存在四种稳定的铁原子,分别是54Fe、56Fe、57Fe和58Fe,其中58Fe原子中子数与质子数之差为___________。
计算铁元素的近似相对质量的计算式为:54×a1%+56×a2%+57×a3%+58×a4%,其中a1%、a2%……是指各同位素的____________________。
(2)铁原子中有______种能量不同的电子,铁原子次外层的电子云有_____种不同的伸展方向。
(3)与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为________________________________。
(4)要用铁片、锌片、直流电源和导线完成铁片镀锌的实验,铁片应置于_________极,电解质溶液是____________________。
(5)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+,配平制取高铁酸钠的化学方程式:
___Fe(NO3)3 + ___NaOH + ___Cl2 →___Na2FeO4 + ___NaNO3 + ___NaCl + ___H2O
高铁酸钠除了能消毒杀菌外,还能吸附水中的悬浮物,其原因是______________________。
(6)0.03mol的铁加到过量的HNO3中,加热,铁完全溶解,若生成NO、NO2的混和气体共1.12L(标准状况)。将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体全部溶于水生成HNO3,则通入O2的体积________________L。
氨有着广泛的用途,可用于化肥、硝酸、合成纤维等工业生产。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应可生成氨气:
该反应在固定体积的密闭容器中进行,有关说法正确的是_____________(填序号字母)。
A.反应处于平衡状态时,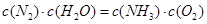 |
B.反应达到平衡后, |
| C.体系的总压强不变,说明反应已达平衡 |
| D.混合气体的密度保持不变,说明反应已达平衡 |
(2)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧试验机中相关的反应有: ①
① ②
② ③
③
请写出上述三个反应中 、
、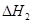 、
、 三者之间关系的表达式,
三者之间关系的表达式, =_________。
=_________。
(3)工业制硝酸的主要反应是:
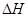 =
=
①升高温度,反应的K值减小,则Q______(填“>”、“<”或“=”)0。
②若反应起始的物质的量相同,下列关系图错误的是________(填序号)。

③在容积固定的密闭容器中发生上述反应,容器内部分物质的浓度如下表:
| 时间/浓度 |
  |
  |
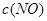  |
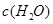  |
| 起始 |
4.0 |
5.5 |
0 |
0 |
| 第2min |
3.2 |
a |
0.8 |
1.2 |
| 第4min |
2.0 |
3.0 |
2.0 |
3.0 |
| 第6min |
2.0 |
3.0 |
2.0 |
3.0 |
反应在第2 min到第4 min时,O2的平均反应速率为________。
反应在第2 min时改变了条件,改变的条件可能是______________________________。
该条件下,反应的平衡常数K=________。
某化学兴趣小组利用废弃铝矿(含CuO、Al2O3及SiO2),模拟工业上提取铝的工艺,设计如下图所示的简单操作流程:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
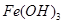 |
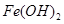 |
 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)滤渣主要成分的化学式为______________________。
(2)灼烧 时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有___________(填仪器名称)。
时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有___________(填仪器名称)。
(3)溶液Y中要加入稍过量原料A,原料A的化学式是_________,步骤⑤反应的离子方程式是_______________________。
(4)操作流程中③的离子方程式为_______________________。
(5)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如图所示:
请写出该电池正极反应式_________________;常温下,用该化学电源和惰性电极电解300mL氯化钠溶液(过量),消耗27mg Al,则电解后溶液的pH=_________(不考虑溶液体积的变化)。
(6)以熔融盐为电镀液可以在钢材表面镀铝,镀铝电解池中,钢材为________极;镀铝后能防止钢材腐蚀,其原因是____________________________________。