化学实验中,同一个装置可以用于不同的实验,例如图的实验装置(B中可为固体或液体,可加热)。
(1)若A中为浓盐酸,B中为高锰酸钾固体,D中为石蕊溶液,则D中现象为________________________。
(2)若A中为足量的浓硝酸,B中为铜单质,D中用NaOH来吸收其产生的气体,请写出D中所发生的反应的化学方程式________________________________________________。
(3)若A中为浓H2SO4,B中为NaCl固体, D中是Na2S与Na2SO3的混合溶液,打开分液漏斗后,加热,D中出现黄色沉淀并有臭鸡蛋气味的气体逸出,则D中n(Na2S)与n(Na2SO3)需满足的条件是______________________________。
(4)该装置可以模拟氨碱法制纯碱,D中为饱和食盐水。先制取________气体通入D中至饱和,再制取_______气体也通入D中,此时可以看到溶液中有晶体析出。请写出该反应的化学方程式___________________________________________________。
(5)利用上述装置,下列实验不可能实现的是_____________________
| A.证明碳酸比苯酚的酸性强 | B.证明氯气的氧化性比溴强 |
| C.用乙醇制备并检验乙烯 | D.制备并收集乙酸乙酯 |
(6)若A中为稀硫酸,B中为碳酸氢钠固体,打开分液漏斗反应一段时间,D中先无现象,后慢慢产生沉淀且不溶解,则D溶液的原溶质可能是______________________________。
(物质结构与性质)金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的电子排布式为:。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。电负性:C(填“>”或“<”,下同)B;第一电离能:NO 。
(3)月球岩石——玄武岩的主要成分为钛硫酸亚铁 与80%的硫酸反应可生成
与80%的硫酸反应可生成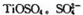 的空间构型为形,其中硫原子采用杂化。
的空间构型为形,其中硫原子采用杂化。
(4)磷酸肽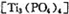 锂离子电池能来那个密度大、安全性高。
锂离子电池能来那个密度大、安全性高。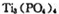 可由
可由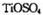 与
与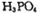 反应制得。两分子
反应制得。两分子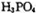 发生脱水生成焦磷酸:
发生脱水生成焦磷酸: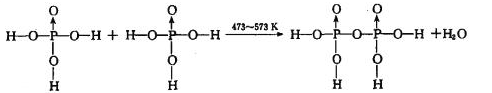
则三分子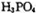 脱去两分子
脱去两分子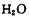 生成三磷酸,其结构式为,四分子
生成三磷酸,其结构式为,四分子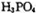 脱去四分子
脱去四分子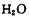 生成的四偏磷酸属于元酸。
生成的四偏磷酸属于元酸。
(5)Ti的氧化物和CaO相互作用能形成太酸盐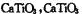 的晶体结构如图所示(Ti位于立方体的顶点)。该晶体中Ti4+和周围个O2-紧邻。
的晶体结构如图所示(Ti位于立方体的顶点)。该晶体中Ti4+和周围个O2-紧邻。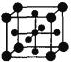
(6)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中
实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重
大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为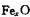 (x<1),若测得某
(x<1),若测得某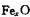 晶体密度为5.71g·cm-3,晶胞边长为4.28×
晶体密度为5.71g·cm-3,晶胞边长为4.28× m,则
m,则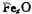 中x=。
中x=。
(化学与技术)某硫酸厂以含有SO2的尾气、氨气等为原料,合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
(1)写出反应Ⅲ的化学方程式:。
(2)下列有关说法正确的是(填字母)
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
| B.反应Ⅱ和反应Ⅲ的基本反应类型相同 |
C.反应Ⅳ需控制在60---70 ,目的之一是减少碳酸氢铵的分解 ,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
(3)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式:。
(4)很多硫酸厂为回收利用SO2,直接用氨水吸收法处理尾气。
① 用15.0 mL 2.0 mol/L氨水吸收标准状况下448 mL SO2,吸收液中的溶质为
。
② 某同学用酸性KMnO4溶液滴定上述吸收液,当达到滴定终点时,消耗KMnO4溶液25.00 mL,则酸性KMnO4,溶液中c(KMnO4) =。
(5)氨气用途广泛,可以直接用于燃料电池,下图是用氨水作原料的燃料电池的工作原理。
氨气燃料电池的电解质溶液最好选择(填“酸性”、“碱性”或“中性”)溶液,氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池总反应的化学方程式是,负极的电极反应式是
。
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含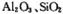 等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫。
等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫。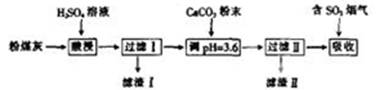
(1)(填“能”或“不能”)用NaOH溶液代替H2SO4溶液。
(2)酸浸时反应的离子方程式为。
(3)加CaCO3调节溶液的pH至3.6其目的是。
(4)已知粉煤灰中Al2O3的质量分数为40.8%,制得的碱式硫酸铝[Al2(SO4)x(OH)6-2x]中x=1.5。某实验小组取80.0g粉煤灰进行上述实验,假设在整个过程中铝的损耗率为10%,则可制得碱式硫酸铝的质量为。
甲醇是一种重要的有机化工原料,可用于制取甲醚。一定温度下,在三个体积均为1.0 L的恒容密闭容器中发生反应: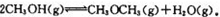
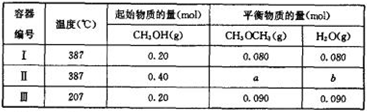
(1)该反应的化学平衡常数表达式为K=。
(2)该反应的正反应为(填“放热”或“吸热”)反应。
(3)容器Ⅰ中的反应达到平衡时所需的时间(填“大于”“小于”或“等于”) 容器Ⅱ中的
(4)a=,b=
(5)已知下面两个反应(m、n均大于0):
反应①: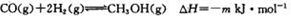
反应②: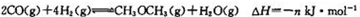
则下列m与n的关系中,正确的是(填字母)。
A n>2m B m>2n C n=m D m>3n
氮的氧化物对人体危害极大,实验时应防止其对空气的污染。
实验一:某同学利用下列装置实现铜与浓硝酸、稀硝酸的反应。
Ⅰ、取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3]。
Ⅱ、将洗涤后的铜丝做成匝数较多的螺旋状。
Ⅲ、按如图所示装置连接仪器、检查气密性、装入化学试剂。
(1)请完成过程Ⅰ发生反应的离子方程式:
Cu2(OH)2CO3+4H+=。
(2)过程Ⅲ的后续操作如下:
① 为使浓硝酸与铜丝接触,操作是打开止水夹a和b,,当红棕色气体较多时,轻抽注射器使反应停止,关闭a,取下注射器。生成红棕色气体的化学方程式是。
② 控制b与分液漏斗活塞,玻璃管充满稀硝酸时,关闭b打开a,可见有无色气体产生。稀硝酸充满玻璃管的目的是。
实验二:NO2与水反应的实验研究。
(3)将3支充满红棕色气体的小试管分倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致。结果如下表所示(忽略温度对气体体积的影响):
① 根据上表得出的结论是温度越(填“高”或“低“),进入试管中的溶液越多。
② 查阅材料:a.NO2与水反应的实际过程为:2NO2+ H2O=HNO3+ HNO2,3 HNO2= HNO3+2NO↑+H2O;b. HNO2不稳定。则产生上述现象的原因是。