右表是元素周期表的一部分。X、Y、Z、W均为短周期元素,X、W的质子数之和为23。下列说法正确的是 ( )
| |
X |
|
Y |
| Z |
|
W |
|
| A.原子半径:W>Y |
| B.氢化物的稳定性:Y<Z |
| C.最高价氧化物对应水化物的酸性:W>Z |
| D.Z的氧化物不能溶于Y的氢化物的水溶液 |
下述实验设计能够达到目的的是()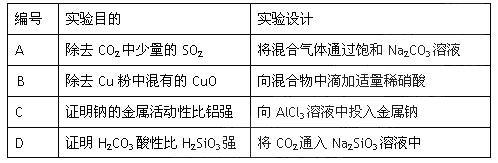
下列各组单质中,前者能将后者从化合物中置换出来的是()
①Al、Fe②C、Si③Mg、C④H2、Cu
A.只有①③ B.只有②④ C.①②③④ D.只有①②④
下列实验中金属或金属氧化物可以完全溶解的是()
| A.1 mol铜片与含2 mol H2SO4的浓硫酸共热 |
| B.常温下1 mol铝片投入足量的浓硫酸中 |
| C.1 mol MnO2粉末与含2 mol H2O2的溶液共热 |
| D.常温下1 mol铜片投入含4 mol HNO3的浓硝酸中 |
某同学通过系列实验探究Mg及其化合物的性质,操作正确且能达到目的的是()
| A.将水加入浓硫酸中得到稀硫酸,置镁条于其中探究Mg的活泼性 |
| B.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 |
| C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 |
| D.将Mg(OH)2沉淀转入蒸发皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体 |
下列装置或操作能达到实验目的的()