铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2 2Cu+SO2
2Cu+SO2
湿法炼铜:CuSO4+Fe=====FeSO4+Cu
上述两种方法中,铜元素均被 (填“氧化”或“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如下: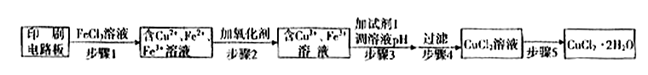 ①证明步骤I所加FeCl3溶液过量的方法是 。
①证明步骤I所加FeCl3溶液过量的方法是 。
②步骤2中所加的氧化剂最适宜的是 。
A.HNO3 B.H2O2 C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是 。(写出一种即可)
④蒸发农缩CuCl2溶液时,要滴加浓盐酸,目的是 (用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。
方法二:用H2O2和稀硫酸共同浸泡印刷电路板制备硫酸铜时,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(nq)===CuSO4(aq)+2H2O(l)△H1=-320kJ/mol
又知:2H2O2(l)==2H2O(l)+O2(g) △H2=-196kJ/mol
H2(g)+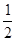 O2(g)==H2O(l) △H3=-286kJ/mol
O2(g)==H2O(l) △H3=-286kJ/mol
则反应Cu(s)+H2SO4(aq)==CuSO4(aq)+H2(g)的△H= 。
(3)欲实现反应Cu+H2SO2==CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)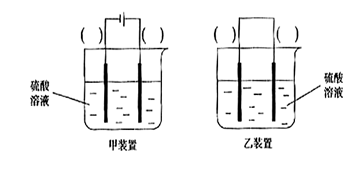
(1)某种粒子有1个原子核,核中有8个质子,10个中子,核外有10个电子,该粒子的化学符号(包含质子数、质量数)是。
(2)某分子中有5个原子核,共有10个电子,这种分子的电子式是。
(3)下列变化中,破坏的作用力分别是什么?
食盐加热熔化:;碘升华:。
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用
还原
可得到金属钨,其总反应为:
请回答下列问题:
⑴ 上述反应的化学平衡常数表达式为。
⑵ 某温度下反应达平衡时,
与水蒸气的体积比为2:3,则
的平衡转化率为;随温度的升高,
与水蒸气的体积比减小,则该反应为反应(填"吸热"或"放热")。
⑶上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 |
25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
| 主要成份 |
第一阶段反应的化学方程式为;580℃时,固体物质的主要成分为;假设
完全转化为
,则三个阶段消耗
物质的量之比为。
⑷ 已知:温度过高时,
转变为
;
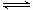
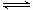
则
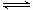 的
。
的
。
⑸ 钨丝灯管中的
在使用过程中缓慢挥发,使灯丝变细,加入
可延长灯管的使用寿命,其工作原理为:
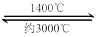 。下列说法正确的有。
。下列说法正确的有。
a.灯管内的
可循环使用
b.
在灯丝上分解,产生的
又沉积在灯丝上
c.
在灯管壁上分解,使灯管的寿命延长
d.温度升高时,
的分解速率加快,
和
的化合速率减慢
萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成a-萜品醇G的路线之一如下: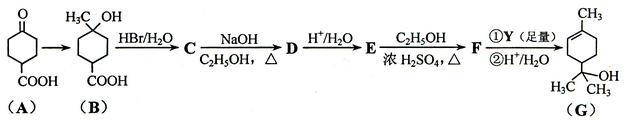
已知:
请回答下列问题:
⑴
所含官能团的名称是。
⑵
催化氢化得
,写出
在一定条件下聚合反应的化学方程式:。
⑶
的分子式为;写出同时满足下列条件的
的链状同分异构体的结构简式:。
① 核磁共振氢谱有2个吸收峰② 能发生银镜反应
(4)
、
的反应类型分别为、。
⑸
的化学方程式为。
⑹ 试剂
的结构简式为。
⑺ 通过常温下的反应,区别
、
和
的试剂是和。
⑻
与
催化加成得不含手性碳原子(连有4个不同原子或原子团的碳原子叫手性碳原子)的化合物
,写出
的结构简式:。
、
、
、
、
五种元素分属三个短周期,且原子序数依次增大。
、
同主族,可形成离子化合物
;
、
同主族,可形成
、
两种分子。
请回答下列问题:
⑴
在元素周期表中的位置为。
⑵ 上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式),非金属气态氢化物还原性最强的是(写化学式)。
⑶
、
的单质或两元素之间形成的化合物可作水消毒剂的有(写出其中两种物质的化学式)。
⑷
的燃烧热
,写出
燃烧反应的热化学方程式:
⑸
的电子式为;
与水反应放出气体的化学方程式为。
⑹ 熔融状态下,
的单质和
能组成可充电电池(装置示意图如下),反应原理为:
2
+
 ;放电时,电池的正极反应式为:充电时,(写物质名称)电极接电源的负极;该电池的电解质为。
;放电时,电池的正极反应式为:充电时,(写物质名称)电极接电源的负极;该电池的电解质为。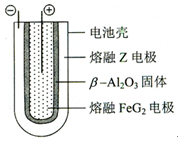
是一种可降解的聚酯类高分子材料,可由马来酸酐等原料经下列路线合成:
(已知: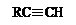 +
+ 

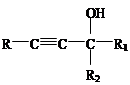 )
)
(1)
的反应类型是;
的结构简式是。
(2)
中含有的官能团名称是;
的名称(系统命名)是。
(3)半方酸是马来酸酐的同分异构体,分子中含1个环(四元碳环)和1个羟基,但不含
键。半方酸的结构简式是。
(4)由
和
合成
的化学方程式是。
(5)下列关于
的说法正确的是。
a.能使酸性
溶液或溴的
溶液褪色
b.能与
反应,但不与
反应
c.能与新制
反应
d.1
完全燃烧消耗5