下图中是中学化学的常见物质,其中E、F、G、Z、W是单质,B的化学式是E2F3。它们有如下转化关系。

①A、B的化学式分别为 、 。
②写出C和E、B和y反应的化学方程式 、
。
已知反应X(g)+Y(g)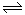 R(g)+Q(g)的平衡常数与温度的关系如下表。830℃时,向一个2L的密闭容器中充入0.2 molX和0.8 mol Y,反应初始4s内v(X)=0.005mol/(L·s)下列说法正确的是
R(g)+Q(g)的平衡常数与温度的关系如下表。830℃时,向一个2L的密闭容器中充入0.2 molX和0.8 mol Y,反应初始4s内v(X)=0.005mol/(L·s)下列说法正确的是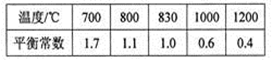
| A.4s时容器内c(Y)="0.76" mol/L |
| B.830℃达平衡时,X的转化率为80% |
| C.反应达平衡后,升高温度,平衡正向移动 |
D.1200℃时反应R(g)+Q(g) 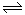 X(g)+Y(g)的平衡常数K=0.4 X(g)+Y(g)的平衡常数K=0.4 |
海水中含有丰富的锂资源,研究人员开发了一种只能让锂离子通过的特殊交换膜,并运用电解实现从海水中提取高浓度的锂盐,其工作原理如图所示。下列说法不正确的是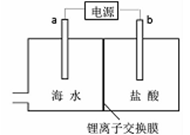
| A.a连接电源的正极 |
| B.Li+的移动方向是从海水进入到盐酸中 |
| C.一段时间后,b电极附近溶液的pH降低 |
| D.电解过程中还可能获得有经济价值的副产物氢气和氯气 |
下列溶液中微粒的物质的量浓度关系正确的是
| A.氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO) |
| B.Na2CO3溶液:c(OH-)=c(HCO3-)+c(H2CO3) +c(H+) |
| C.等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) |
| D.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
碱性电池具有容量大、放电电流大的特点,因而得到广泛使用,锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应为:ZN(s)+2MNO2(s)+H2O(l)﹦ZN(OH)2(s)+MN2O3(s)。下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MNO2(s)+H2O(l)+2e-﹦MN2O3(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
下列有关实验装置进行的相应实验,能达到实验目的的是
| A.图1可证明乙醇发生消去反应生成了乙烯 |
| B.图2用于实验室制备乙酸乙酯 |
| C.图3用于配制银氨溶液 |
| D.图4用于实验室制硝基苯 |