经质潜法分析得知,某单烯烃Q的相对分子质量为56;其核磁共振氢谱与红外光谱表明,Q分子中有两种化学环境不同的氢原子,氢蘑峰面积显示两种氢的原子个数比为1:3(Q分子中含有支链)。
(1)O的结构简式为 。
(2)在锂离子电池中,需要一种有机聚合物作为正负极之问锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如右:
M的合成方法之一如下: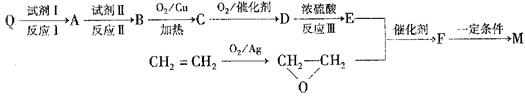
请回答下列问题:
①合成M的反应中,反应I和反应III的反应类型分别是 、 ;
试剂Ⅱ是 ,C中含有官能团的名称是 。
②E的结构简式是 。
③M与足量氯氧化钠溶液反应的化学方程式是 。
(3)D在一定条件下?能发生缩聚反应生成高聚物,请写出D发生缩聚反应的化学方程式 。
(4)已知:I.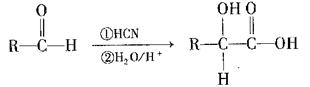 (其中R为烃基)
(其中R为烃基)
II.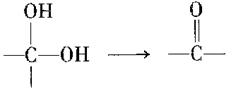
若 ,请写出符合下列条件的物质的一种结构简式 。
,请写出符合下列条件的物质的一种结构简式 。
a.碳骨架与w相同;
b.能发生银镜反应;
c.1mol该物质与足量金 属钠作用生成1.5molH2;
属钠作用生成1.5molH2;
d.分子中每个碳原子上不同时连有两个官能团。
Ⅰ.按要求填空(每空1分)
①KOH的电子式:②NH4Cl的电子式:
③CO2的结构式:④HClO的结构式:
Ⅱ.按要求填空(每空2分)
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa(25℃时)时,已知0.5mol液态肼与足量氧气反应,生成氮气和水蒸气,放出312 KJ的热量。N2H4完全燃烧反应的热化学方程式是;又已知H2O(l)==H2O(g);△H = +44kJ∙mol-1,由64g液态肼与氧气反应生成液态水时放出的热量是kJ。
已知物质A分子式为C3H4O2,显酸性。F为由七个原子组成的环状结构,分子式为C6H8O4 。请根据以下框图回答问题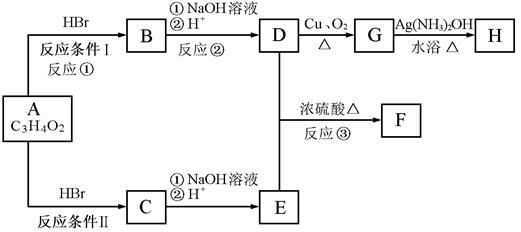
(1)A的结构简式为
(2)反应①的反应类型为
(3)化合物B中含氧官能团的名称是
(4)D和E生成F的化学方程式
D和E按照1:1反应也可生成高聚物,请写出生成该高聚物的化学反应方程式:
(5)G生成H的化学方程式
(6)写出C的同分异构体中属于酯类物质的结构简式、、(至少写3个)
某有机物A含有C、H、O三种元素,其蒸气密度是相同条件下H2密度的29倍,把1.16g该有机物在O2中充分燃烧,将生成物通过足量碱石灰,碱石灰增重3.72g,又知生成的CO2和H2O的物质的量之比为1:1 。
(1)有机物A的分子式
(2)该有机物的红外光谱显示该分子是有一个羟基,无甲基的链状结构,请写出A的结构简式 。
(3)已知聚乳酸 是一种很有前途的可降解高分子材料,可制成袋子替代日常生活中的大部分塑料袋。请完成以有机物A为原料合成聚乳酸的路线(无机试剂任选)
是一种很有前途的可降解高分子材料,可制成袋子替代日常生活中的大部分塑料袋。请完成以有机物A为原料合成聚乳酸的路线(无机试剂任选)
|

(1)为实现以下各步的转化,请在括号中填入适当的试剂
①②③④⑤
(2)分子式为C4H10O的有机化合物,能在催化剂作用下连续氧化生成羧酸,请写出它可能的结构简式为_____________ 、_____________ 。当C与4个不同的原子或基团相连时该碳原子称作“手性”碳原子。则分子式为C4H10O的有机化合物中,含有“手性”碳原子的结构简式为________________。该有机物的系统命名为:
(1)有下列五组物质:
A、O2和O3
B 、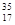 Cl和
Cl和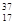 Cl
Cl
C 、H3CCOOC2H5与CH3COOCH3
D、CH3CH2CH2CH3与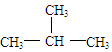
E、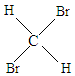 与
与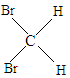
①组两种物质互为同位素;
②组两种物质互为同素异形体;
③组两种物质互为同系物;
④组两种物质互为同分异构体;
⑤组两种物质实为同一物质。
(2)现有六种有机物:
A、CH3OH
B、(CH3)3CCH2OH
C、(CH3)3COH
D、(CH3)2CHOH
E、C6H5CH2OH
F、(CH3)2CHCl
①能被氧化铜氧化生成醛的有②能被氧化铜氧化成酮的有
③能发生消去反应生成烯烃的有
(3)现有四种有机物:
A、(CH3)2CHClB、CH3CH2OOCH
C、OHCCH2COOHD、CH3COOCH2
①能与新制Cu(OH)2反应的有②能与NaOH水溶液反应的有