短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下:
| 元素 |
有关信息 |
| X |
最外层电子数是次外层的2倍 |
| Y |
元素主要化合价为—2价 |
| Z |
其单质及化合物的焰色为黄色 |
| M |
与X同主族,其单质为半导体材料 |
| N |
 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
(1)XY2的电子式是 ;Z2Y2中所含化学键类型是 ;XY2与Z2Y2反应的化学方程式是 。
(2)恒容条件下,一定量的NY2、Y2发生反应:2NY2(g)+Y2(g)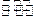 2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如右图,该反应的△H 0(填“>”“<”或“=”,下同);若T1、T2时刻反应的化学平衡常数分别为K1、K2,则K1 K2。
2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如右图,该反应的△H 0(填“>”“<”或“=”,下同);若T1、T2时刻反应的化学平衡常数分别为K1、K2,则K1 K2。
(3)X的非金属性比M (填“强”或“弱”),能证明此结论的事实是 (用离子方程式表示)。
卤族元素包括氟(F)、氯(Cl)、溴(Br)、碘(I),请预测下列物质的性质:
(1)熔点: F2Cl2(填“<”或“=”“或>”,下同),沸点:HFHCl,一定压强下HF和HCl的混合气体降温时(填HF或HCl)先液化。
(2)分解温度:HFHCl,熔点:NaFSiF4
.已知醛在一定条件下可以发生如下转化: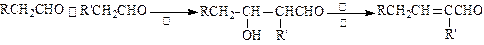
物质B是一种可以作为药物的芳香族化合物,请根据下图(所有无机产物均已略去)中各有机物的转变关系回答问题: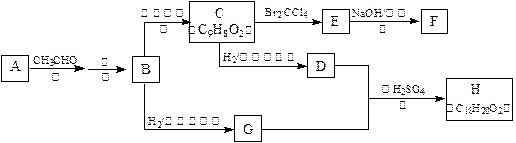
(1)A、B的结构简式为:A__________________,B_________________。
(2)G、D反应生成H的化学方程式是:___________________________。
(3)一定条件下,能够与1mol F发生反应的H2的最大用量是:_______ mol。
(4)G有多种同分异构体,其中能与金属反应且苯环上只有一个取代基的同分异构体的结构简式为:_______________、_________________、__________________、__________________。
有机物A与乙酸无论以何种比例混合,只要质量一定,完全燃烧后产生的水的质量也一定,回答:
⑴ 满足题干条件的A应与乙酸具有相同的___________________
(2) 若A与乙酸相对分子质量相等,且既能发生银镜反应又能发生酯化反应,则A的结构简式为_____________。
(3)若A由四种元素形成的两种官能团组成,相对分子质量与乙酸相等,且分子中氢原子都不与碳原子相连,则A的结构简式为_____________。
(4)若A分子中氧元素质量分数为13.33%,其余为C、H且其原子个数比为1:1,,且A的相对分子质量小于200,则A的分子式为___________。
(1) 命名: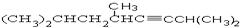
(2)相对分子质量为72且沸点最低的烷烃的结构简式
国家游泳池水质标准:
| 游离性余氯 |
0.3~0.5 mg·L-1 |
| pH |
6.5~8.5 |
| 浑浊度 |
≤5度 |
| 细菌总数 |
≤1 000个/mL |
| 大肠菌群 |
≤18个/mL |
| 硫酸铜剂量 |
0.25~0.50 mg·L-1,最大加药量不超过1.0 mg·L-1 |
*游离性余氯:包括ClO-及HClO等。
请参考表中有关信息回答以下问题:
(1)游泳池一般用漂白精作为消毒剂,漂白精的有效成分是Ca(ClO)2,其消毒原理是_________________________________。
(2)池中加入硫酸铜的目的是__________________,如果加入硫酸铜的剂量过大会对人体产生有害作用,其原因是什么?_________________________________。
(3)某游泳池注满水,水的总体积为1.50×103 m3,该游泳池消毒一次所用的漂白精,理论上需用多少升标准状况下的氯气和多少克氢氧化钙来制取?(列式计算)(池水的密度为1.00 g·cm-3,游离性余氯按ClO- 0.50 mg·L-1计)