(16分)
有机物DBP常用作纤维素树脂和聚氯乙烯的增塑剂,特别适用于硝酸纤维素涂料。具有优良的溶解性、分散性和粘着性。由有机物A和邻二甲苯为原料可以合成DBP。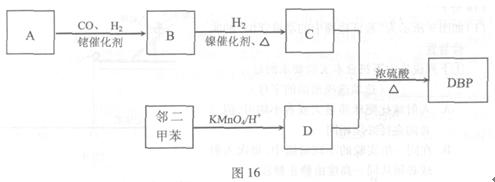
已知:① ;
;
②烃A是有机合成的重要原料。A的质谱图表明其相对分子质量为42,红外光谱表明分子中含有碳碳双键;B能发生银镜反应;有机物c的核磁共振氢谱显示其分子中含有5种氢原子,且其峰面积之比为3:2:2:2:1;DBP分子中苯环上的一溴取代物只有两种。
(1)A的结构简式是 。
(2)B含有的官能团名称是 。
(3)有机物C和D反应生成DBP的化学方程式是 。
(4)下列说法正确的是(选填序号字母) 。
a.A能发生聚合反应、加成反应和氧化反应
b.和C互为同分异构体,且含有相同官能团的有机物有2种
c.邻二甲苯能氧化生成D说明有机物分子中基团之间存在相互影响
d.1 mol DBP可与含2 mol NaOH的溶液完全反应
(5)工业上常用有机物E(C8H4O3)代替D生产DBP。反应分为两步进行:
①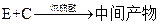 ②
②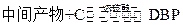
工业生产中在第②步中使用油水分离器将反应过程中生成的水不断从反应体系中分离除去,其目的是 。
(6)工业上生产有机物E的反应如下: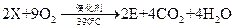
芳香烃X的一溴取代物只有两种,X的的结构简式是 。
乙酰基二茂铁是常用的汽油的抗震剂,由二茂铁合成乙酰基二茂铁的原理如下: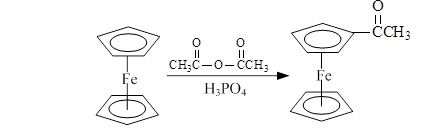
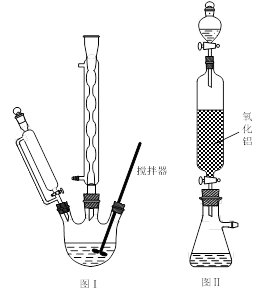
其实验步骤如下:
步骤1:如图Ⅰ所示,取1 g二茂铁与3 mL乙酸酐于装置中,开通搅拌器,慢慢滴加85%磷酸1 mL,加热回流5 min。
步骤2:待反应液冷却后,倒入烧杯中加入10 g碎冰,搅拌至冰全部融化,缓慢滴加NaHCO3溶液中和至中性,置于冰水浴中15 min。抽滤,烘干,得到乙酰基二茂铁粗产品。
步骤3:将乙酰基二茂铁粗产品溶解在苯中,从图Ⅱ装置的分液漏斗中滴下,再用乙醚淋洗。
步骤4:将其中一段时间的淋洗液收集,并进行操作X,得到纯净的针状晶体乙酰基二茂铁并回收乙醚。
⑴步骤2中的抽滤操作,除烧杯、玻璃棒外,还必须使用属于硅酸盐材质的仪器有 。
⑵步骤2中不需要测定溶液的pH就可以判断溶液接近中性,其现象是 。
⑶步骤3将粗产品中杂质分离实验的原理是 。
⑷步骤4中操作X的名称是 ,该操作中不能使用明火的原因是 。
⑸为确定产品乙酰基二茂铁中是否含有杂质二乙酰基二茂铁(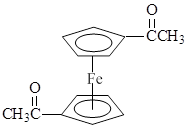 ),可以使用的仪器分析方法是 。
),可以使用的仪器分析方法是 。
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
21.A.《物质结构与性质》
在5-氨基四唑( )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
⑴基态Ga原子的电子排布式可表示为 ;
⑵5-氨基四唑中所含元素的电负性由大到小的顺序为 ,其中N原子的杂化类型为 ;在1 mol 5-氨基四唑中含有的σ键的数目为 。
⑶叠氮酸钠(NaN3)是传统安全气囊中使用的气体发生剂。
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的空间构型为 。
②以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构是用碳原子取代氮化钛晶胞(结构如右图)顶点的氮原子,这种碳氮化钛化合物的化学式为 。
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
⑴250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 |
CH4 |
CO2 |
CO |
H2 |
| 体积分数 |
0.1 |
0.1 |
0.4 |
0.4 |
①此温度下该反应的平衡常数K= 。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H=2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H= 。
2CO(g)+2H2(g) 的△H= 。
⑵以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。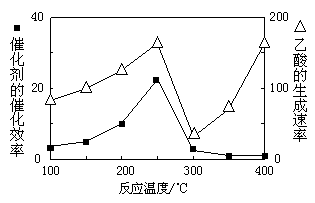
②为了提高该反应中CH4的转化率,可以采取的措施是 。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为 。
⑶以CO2为原料可以合成多种物质。
①聚碳酸酯是一种易降解的新型合成材料,它是由缩聚而成。写出聚碳酸酯的结构简式: 。
②以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应方程式为 。
硅藻土是由硅藻死亡后的遗骸沉积形成的,主要成分是 SiO2和有机质,并含有少量的Al2O3、Fe2O3、MgO 等杂质。精制硅藻土因为吸附性强、化学性质稳定等特点被广泛应用。下图是生产精制硅藻土并获得Al(OH)3的工艺流程。 ⑴粗硅藻土高温煅烧的目的是 。
⑴粗硅藻土高温煅烧的目的是 。
⑵反应Ⅲ中生成Al(OH)3沉淀的化学方程式是 ;氢氧化铝常用作阻燃剂,其原因是 。
⑶实验室用酸碱滴定法测定硅藻土中硅含量的步骤如下:
步骤1:准确称取样品a g,加入适量KOH固体,在高温下充分灼烧,冷却,加水溶解。
步骤2:将所得溶液完全转移至塑料烧杯中,加入硝酸至强酸性,得硅酸浊液。
步骤3:向硅酸浊液中加入NH4F溶液、饱和KCl溶液,得K2SiF6沉淀,用塑料漏斗过滤并洗涤。
步骤4:将K2SiF6转移至另一烧杯中,加入一定量蒸馏水,采用70 ℃水浴加热使其充分水解(K2SiF6+3H2O=H2SiO3+4HF+2KF)。
步骤5:向上述水解液中加入数滴酚酞,趁热用浓度为c mol·L-1 NaOH的标准溶液滴定至终点,消耗NaOH标准溶液VmL。
①步骤1中高温灼烧实验所需的仪器除三角架、泥三角、酒精喷灯外还有 。
a.蒸发皿 b.表面皿 c.瓷坩埚 d.铁坩埚
②实验中使用塑料烧杯和塑料漏斗的原因是 。
③步骤3中采用饱和KCl溶液洗涤沉淀,其目的是 。
④步骤5中滴定终点的现象为 。
⑤样品中SiO2的质量分数可用公式“ ×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
莫沙朵林是一种镇痛药,它的合成路线如下: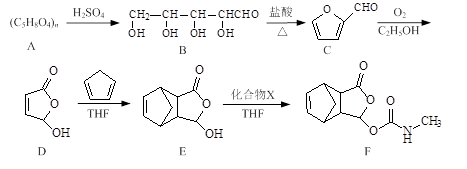
⑴B中手性碳原子数为 ;化合物D中含氧官能团的名称为 。
⑵C与新制氢氧化铜反应的化学方程式为 。
⑶写出同时满足下列条件的E的一种同分异构体的结构简式: 。
I.核磁共振氢谱有4个峰;
Ⅱ.能发生银镜反应和水解反应;
Ⅲ.能与FeCl3溶液发生显色反应。
⑷已知E+X→F为加成反应,化合物X的结构简式为 。
⑸已知: 。化合物
。化合物 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以 和
和 为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。合成路线流程图示例如下:
为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。合成路线流程图示例如下: