本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
21.A.《物质结构与性质》
在5-氨基四唑( )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。

⑴基态Ga原子的电子排布式可表示为 ;
⑵5-氨基四唑中所含元素的电负性由大到小的顺序为 ,其中N原子的杂化类型为 ;在1 mol 5-氨基四唑中含有的σ键的数目为 。
⑶叠氮酸钠(NaN3)是传统安全气囊中使用的气体发生剂。
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的空间构型为 。
②以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构是用碳原子取代氮化钛晶胞(结构如右图)顶点的氮原子,这种碳氮化钛化合物的化学式为 。
(10分)由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有下图所示的转化关系,已知C是密度最小的气体,甲是电解质。
根据图示转化关系回答:
(1)写出下列物质的化学式:
A________,B________,乙________,丁________。
(2)组成单质A的元素在周期表中的位置是_____________,丙的电子式是
(3)写出下列变化的方程式:
①A与NaOH溶液反应的化学方程式:_______________ ___________________________
___________________________
②乙与过量CO2反应的离子方程式:__________________________________________。
(14分)有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+ 、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4 mol淡黄色粉末时,产生气体0.3 mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如下图所示。
、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4 mol淡黄色粉末时,产生气体0.3 mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如下图所示。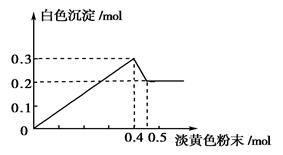
根据题意回答下列问题:
(1)淡黄色粉末为____________(填名称)。
(2)溶液中肯定有______________离子,肯定没有__________离子。
(3)溶液中各离子的物质的量之比为
________________________________________________________________________。
(4)写出下列反应方程式:
①淡黄色粉末与水反应的化学方程式:____________________________________。
②刺激性气味的气体产生的离子方程式:______________________________________。
③沉淀部分减少时的离子方程式:_______________________________________。
阅读下列材料后,完成相应问题。
一个体重50 kg的健康人,含铁2 g。这2 g铁在人体中不以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在。二价铁离子(亚铁离子)易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可以使食物中的铁离子(三价铁离子)变成亚铁离子,以利于铁的吸收。
(1)人体中经常进行Fe2+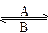 Fe3+的转化,A中Fe2+被__________,B中Fe3+作__________剂。
Fe3+的转化,A中Fe2+被__________,B中Fe3+作__________剂。
(2)从“服用维生素C,可以使食物中的铁离子变成亚铁离子”这句话分析出维生素C在这一反应中作__________剂,具有__________性
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。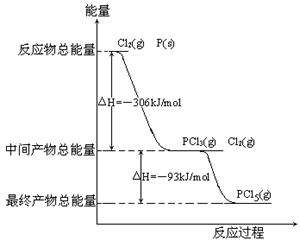
根据上图回答下列问题:
(1)P和Cl2反应生成PCl5(g)的热化学方程式
(2)PCl5(g)分解成PCl3(g)和Cl2的热化学方程式
上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入1.60molPCl5,反应达到平衡时PCl5有1.20mol,其分解率α1,若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,则α2_______α1(填“大于”、“小于”或“等于”)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是_________________________________。
(4)P和Cl2分两步反应生成1molPCl5的焓变为△H3,P和Cl2一步反应生成1molPCl5的焓变为△H4,则△H4______△H3(填“大于”、“小于”或“等于”)。
(5)以红磷P(s)和Cl2(g)制备PCl5,为提高Cl2(g)的转化率可采用的措施是:
(任填两种措施)
(6分)可逆反应①X(g)+2Y(g) 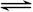 2Z(g) 、②2M(g)
2Z(g) 、②2M(g)  N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示: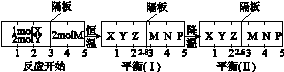
则X(g)+2Y(g)  2Z(g)正反应为反应(填“放热”或“吸热”)达到平衡(Ⅰ)时X的转化率为(保留小数点后两位数字,下同);假设平衡(Ⅰ)时左边容器(X、Y、Z的体系)的体积为2L,求此温度下的化学平衡常数
2Z(g)正反应为反应(填“放热”或“吸热”)达到平衡(Ⅰ)时X的转化率为(保留小数点后两位数字,下同);假设平衡(Ⅰ)时左边容器(X、Y、Z的体系)的体积为2L,求此温度下的化学平衡常数