(14分)有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+ 、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4 mol淡黄色粉末时,产生气体0.3 mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如下图所示。
、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4 mol淡黄色粉末时,产生气体0.3 mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如下图所示。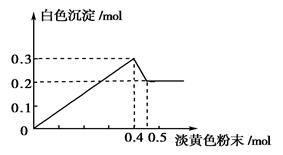
根据题意回答下列问题:
(1)淡黄色粉末为____________(填名称)。
(2)溶液中肯定有______________离子,肯定没有__________离子。
(3)溶液中各离子的物质的量之比为
________________________________________________________________________。
(4)写出下列反应方程式:
①淡黄色粉末与水反应的化学方程式:____________________________________。
②刺激性气味的气体产生的离子方程式:______________________________________。
③沉淀部分减少时的离子方程式:_______________________________________。
32.
(1)在25℃、101kPa下, 1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧热的热化学方程式:。
(2)2Zn(s)+O2(g)=2ZnO(s) ΔH1 =" —702" kJ/mol
2Hg(l)+O2(g)=2HgO(s) ΔH2 =" —182" kJ/mol
由此可知ZnO(s)+Hg(l)= Zn(s)+HgO(s) △H3=。
(3)已知 2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=—99kJ·mol-1.请回答下列问题: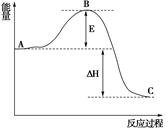
①图中E、C分别表示、,
②E的大小对该反应的反应热有无影响?。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,理由是
③图中△H=kJ·mol-1。
31.B是化学实验室中最常见的有机物,其产量可以用来衡量一个国家的石油化工发展水平,还是一种植物生长调节剂。并能进行如图所示的反应。且D能发生加聚反应。
(1)写出A的结构简式
(2)下列反应的化学方程式和反应类型
反应②:;
(3)写出A与足量的溴水反应的方程式且命名产物:;
(4)写出D在一定条件下发生加聚反应的化学反应方程式:
24.(12分)根据下列变化关系:
已知:E是一种具有果香味、难溶于水的物质,请填空:
(1)A物质的名称____________________。B溶液为__________________________.作用为__________________________________________
(2)写出④、⑥两步反应的化学方程式,在( )号中标明反应类型。
④ _______________________________________________________ ()
⑥_________________________________________________________ ()
23.(7分)对于CH4、C3H4、C2H4、C2H6、C3H6五种烃,回答下列有关问题:
(1)等质量的上述五种烃,在相同状况下体积最大的是______________。
(2)等质量的上述五种烃,完全燃烧生成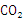 最多的是________________。
最多的是________________。
(3)在120 ℃、1.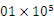 Pa条件下,与足量的
Pa条件下,与足量的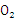 混合点燃,完全燃烧前后气体体积没有变化的烃是___________________________。
混合点燃,完全燃烧前后气体体积没有变化的烃是___________________________。
22、(9分)依据事实,写出下列反应的热化学方程式。
(1)在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O。 放出571.6kJ的热量,表示H2燃烧的热化学方程式为____________。
(2)在25℃、101kPa下,1g甲醇液体燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_______________________________________
(3)已知:已知:C(s)+O2(g)=CO2(g) ΔH="-437.3" kJ·mol一1
H2(g)+  O2(g)=H2O(g) ΔH="-285.8" kJ·mol一1
O2(g)=H2O(g) ΔH="-285.8" kJ·mol一1
CO(g)+  O2(g)=CO2(g) ΔH="-283.0" kJ·mol一1
O2(g)=CO2(g) ΔH="-283.0" kJ·mol一1
则煤的气化主要反应(碳和水蒸气反应生成一氧化碳和氢气)的热化学方程式是________________