有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2-+2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为
A.A>B>E>D B.A>B>D>E C.D>E>A>B D.D>A>B>E
已知H2(g)+Cl2(g)="2HCl(g)" △H=―184.6kJ·mol-1,则反应HCl(g)=1/2H2(g)+1/2Cl2(g) 的△H为()
| A.+184.6kJ·mol-1 | B.―92.3kJ·mol-1 | C.―369.2kJ·mol-1 | D.+92.3kJ·mol-1 |
下列各图中,表示正反应是吸热反应的图是( )。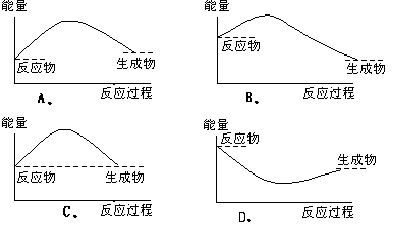
下列叙述中不正确的是()
| A.电解池的阳极上发生氧化反应,阴极上发生还原反应 |
| B.不能自发进行的氧化还原反应可通过电解的原理实现 |
| C.电镀时,电镀池里的阳极材料发生氧化反应 |
| D.电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气 |
某温度下,浓度都是1mol•L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,反应t min后测得c(X2) =0.4mol•L-1,c(Y2)=0.8mol•L-1,生成的c(Z)=0.4mol•L-1,则该反应的化学方程式可表示为()。
A.X2+2Y2 2XY2 2XY2 |
B.2X2+Y2 2X2Y 2X2Y |
C.3X2+Y2 2X3Y 2X3Y |
D.X2+3Y2 2XY3 2XY3 |
下列各组实验中溶液发生生反应最快的是( )
| A.0.1mol/LNa2S2O3和H2SO4各5mL,加水5mL,反应温度10℃ |
| B.0.1mol/LNa2S2O3和H2SO4各5mL,加水10mL,反应温度10℃ |
| C.0.1mol/LNa2S2O3和H2SO4各5mL,加水5mL,反应温度30℃ |
| D.0.2mol/LNa2S2O3和H2SO4各5mL,加水10mL,反应温度30℃ |