化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是
| A.N2(g)+3H2(g)=2NH3(l);ΔH=2(a-b-c) kJ·mol-1 |
| B.N2(g)+3H2(g)=2NH3(g);ΔH=2(b-a) kJ·mol-1 |
C. N2(g)+ N2(g)+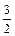 H2(g)=NH3(l);ΔH=(b+c-a) kJ·mol-1 H2(g)=NH3(l);ΔH=(b+c-a) kJ·mol-1 |
D. N2(g)+ N2(g)+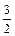 H2((g)=NH3(g);ΔH=(a+b) kJ·mol-1 H2((g)=NH3(g);ΔH=(a+b) kJ·mol-1 |
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3—等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,下列说法正确的是
| A.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| B.ab段发生的离子反应为:Al3++3OH—= Al(OH)3↓,Mg2++2OH—= Mg(OH)2↓ |
| C.原溶液中含有的阳离子必定有H+、NH4+、Al3+、Mg2+ |
| D.d点溶液中含有的溶质只有Na2SO4 |
将标准状况下的VL CO2通入含有a mol氢氧化钠的溶液中经充分反应得溶液I。下列对溶液I中溶质分析正确的是
| A.已知溶液I中溶质的种类和a值,一定能求出V |
| B.已知V和a的具体数值可以确定溶液I的溶质 |
| C.向溶液I中加入足量Ba(OH)2溶液充分反应后,过滤出沉淀,经烘干得固体质量为W克。由W 和V的值可确定溶液I的溶质 |
| D.溶液I中含有溶质的组合可能有3种 |
海洋中蕴藏着丰富资源,对它的开发利用有利于缓解当前资源紧张的困局,工业上从海水中提取的某些无机物的简易流程可以用下图表示: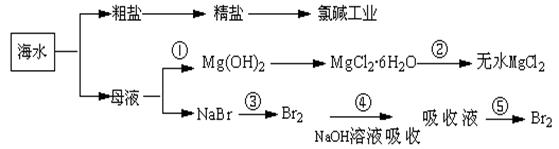
下列有关说法不正确的是
| A.氯碱工业中采用阳离子交换膜电解槽,可以防止氯气与碱的反应 |
| B.第②步中结晶出的MgCl2·6H2O不能采用直接在空气中受热分解制无水MgCl2 |
| C.第①步常采用往母液中加浓NaOH溶液来获取Mg(OH)2 |
| D.从第③步到第⑤步的目的是获得含溴单质浓度较高的溶液 |
下列物质转化在给定条件下能实现的是
①Al2O3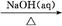 NaAlO2(aq)
NaAlO2(aq)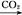 Al(OH)3②S
Al(OH)3②S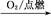 SO3
SO3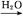 H2SO4
H2SO4
③饱和NaCl(aq)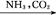 NaHCO3
NaHCO3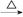 Na2CO3
Na2CO3
④Fe2O3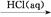 FeCl3(aq)
FeCl3(aq)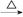 无水FeCl3⑤MgCl2(aq)
无水FeCl3⑤MgCl2(aq)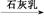 Mg(OH)2
Mg(OH)2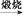 MgO
MgO
| A.①④⑤ | B.①③⑤ | C.②③④ | D.②④⑤ |
下列离子方程式正确的是
A.FeSO4酸性溶液暴露在空气中: 4Fe2++O2+4H+ 4Fe3++2H2O 4Fe3++2H2O |
B.过量石灰水与碳酸氢钙反应:Ca2++2HCO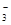 +2OH-===CaCO3↓+CO +2OH-===CaCO3↓+CO +2H2O +2H2O |
C.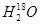 中投入Na2O2固体:2 中投入Na2O2固体:2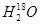 +2Na2O2===4OH-+4Na++18O2↑ +2Na2O2===4OH-+4Na++18O2↑ |
D.向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O===AlO +4NH +4NH +2H2O +2H2O |