研究某一化学反应的实验装置如下图所示:
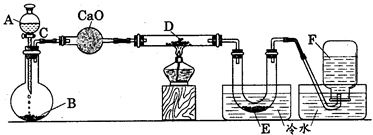 |
A~F属于下列物质中的六种物质:浓硫酸、浓盐酸、浓氨水、稀硫酸、稀盐酸、稀氟水、水、锌粒、铜片、食盐、高锰酸钾、氯化钙、氧化钙、四氧化三铁、氧化铁、氧化铜、氢气、二氧化碳、二氧化氮、一氧化碳、氯气、氯化氢、氨气、氮气、氧气。
实验现象;
(1)D物质由黑色变为红色
(2)无水硫酸铜粉末放入无色透明的E中得到蓝色溶液
(3)点燃的镁条伸入无色无味的F中.镁条表面生成一种灰黄色固体物质。将该发黄色物质放入水中,有气体放出,该气体具有刺激性气味。并能使润湿的红色石蕊试纸变蓝。通过分析回答:
l、写出A~F的物质名称:
A ,B ,C ,D ,E ,F 。
2、写出有关的化学方程式:
A与B ;
C与D ;
E与无水硫酸铜 ;
F与Mg ;
F与Mg的反应产物与水 。
某校化学实验兴趣小组欲采用如图所示的实验装置制Cl2,同时进行与氯气有关的某些实验,按要求回答问题。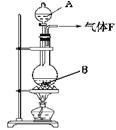
(1)药品A的名称是,此反应的离子方程式是。
(2)甲同学用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,结果制得的Cl2体积(标准状况下)1.12 L(填“大于”“等于”“ 小于”)。
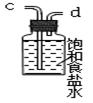
(3)在实验室中,乙同学欲用下图中的装置净化氯气,则气流方向是:
气体F→ → → → (填代号)。
(4)把净化后的氯气通入如下图装置。
①观察到a不褪色,b褪色,可得到的结论是:;②检验吸收Cl2后的NaOH溶液中含有Cl-时,需要滴加的试剂以及现象为。
(5)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧化性强弱的微型装置(如图)。
能说明Cl2的氧化性强于I2的实验现象是:。
某学生用0.1000 mol·L-1的NaOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准NaOH溶液注入碱式滴定管至刻度0以上2~3 cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)______________________________。
(2)上述B步骤操作的目的是_______________________________________。
(3)实验中用左手控制活塞,眼睛注视___________________,直至滴定终点。判断到达终点的现象是________________________________。
(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定 次数 |
待测溶液的体积(mL) |
0.100 0 mol·L-1NaOH的体积(mL) |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积(mL) |
||
| 第一次 |
20.00 |
0.00 |
26.11 |
26.11 |
| 第二次 |
20.00 |
1.56 |
30.30 |
28.74 |
| 第三次 |
20.00 |
0.22 |
26.31 |
26.09 |
依据上表数据列式计算该盐酸溶液的物质的量浓度为
(5)用0.1000 mol·L-1 NaOH溶液滴定0.1000 mol·L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH等于____________
(6)下列哪些操作会使测定结果偏高(填序号)。
A.锥形瓶中溶液的颜色刚刚由无色变为浅红色即停止滴定
B.碱式滴定管用蒸馏水洗净后立即注入标准液
C.滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
E.实验中,用待盛装的溶液润洗锥形瓶
(18分)一氯甲烷,也叫甲基氯,常温下是无色气体,密度为0.9159g/cm3,熔点为-97.73℃,沸点为-24.2℃,18℃时在水中的溶解度为280mL/mL水,与乙醚、丙酮或苯互溶,能溶于乙醇。在实验室里可用下图装置制造一氯甲烷: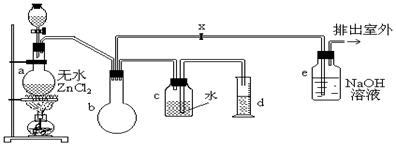
制备装置的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸。
试填写下列空白:
(1)制备一氯甲烷的化学方程式,其反应类型属于反应;
(2)装置b的作用是;
(3)已知卤代烃能发生碱性水解,转化为醇。装置e中可能发生的反应方程式为;
(4)检验气体产物CH3Cl的方法是:在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(与其它烃燃烧现象有明显区别)。CH3Cl燃烧的化学方程式是;
(5)实验中实际按甲醇和浓盐酸1︰2(物质量之比)进行反应的理由是;
(6)某学生在关闭活塞x的情况下做此实验时发现,收集到一定体积的气体产物所消耗的甲醇~
浓盐酸的混和液的量比正常情况下多(装置的气密性没有问题),其原因是;
(7)实验结束后,d中收集到的液体中含有。
某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)
(1)MgCO3的分解产物为。
(2)装置C的作用是,处理尾气的方法为。
(3)将研究小组分为两组,按题26图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。(Fe2+ 遇K3[Fe(CN)6]溶液会生成蓝色沉淀)
| 步骤 |
操作 |
甲组现象 |
乙组现象 |
| 1 |
取黑色粉末加入稀盐酸 |
溶解,无气泡 |
溶解,有气泡 |
| 2 |
取步骤1中溶液,滴加K3[Fe(CN)6]溶液 |
蓝色沉淀 |
蓝色沉淀 |
| 3 |
取步骤1中溶液,滴加KSCN溶液 |
变红 |
无现象 |
| 4 |
向步骤3溶液中滴加新制氯水 |
红色褪去 |
先变红,后褪色 |
①乙组得到的黑色粉末是。
②甲组步骤1中反应的离子方程式为。
③乙组步骤4中,溶液变红的原因为;溶液褪色可能的原因及其验证方法为。
④从实验安全考虑,题图装置还可采取的改进措施是。
某研究性小组借助A-D的仪器装置完成有关实验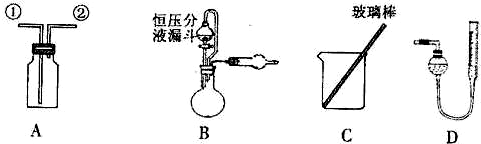
【实验一】收集NO气体.
(1)用装置A收集NO气体,正确的操作是______(填序号)。
a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
c.从②口进气,用排水法集气 d..从②口进气,用排气法集气
【实验二】为了探究镀锌薄铁板上的锌的质量分数ω(Zn)和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO2+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究目标。
(2)选用B和______(填仪器标号)两个装置进行实验。
(3)测得充分反应后生成氢气的体积为VL(标准状况),ω(Zn)=______。
(4)计算镀层厚度,还需要检索的一个物理量是______。
(5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将______(填“偏大”、“偏小”或“无影响”)。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g。
(6)ω(Zn)=______。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标.实验同样使用仪器C。
(7)从实验误差角度分析,方案丙______方案乙(填“优于”、“劣于”或“等同于”)。