已知某硫酸和盐酸的混合溶液中,H+的浓度为0.1mol/L,将50mL上述混合溶液与50mLBa(OH)2溶液混合,充分反应后过滤,得0.466g沉淀,溶液(100mL)中OH-的浓度为0.1mol/L。试求:
(1)原混合溶液中SO42-、Cl-的物质的量。
(2)Ba(OH)2溶液的物质的量浓度。
水杨酸甲酯对多种细菌的繁殖和黏附有抑制作用,也是安全、有效的植物生长调节剂。实验室制备水杨酸甲酯装置示意图和有关数据如下:
反应原理:
实验步骤:
①在干燥的三颈烧瓶中入7.0g水杨酸、30mL(0.64moL)甲醇、3mL浓H2SO4和2~3片碎瓷片,在85~95 ℃下加热回流(如图甲);
②1.5h后将回流装置改为蒸馏装置,水浴加热(如图乙);
③余下的反应液冷却至室温,依次用水、碳酸钠溶液和水洗涤,后再分离(如图丙);
④分出的产物加入少量无水CaCl2固体,静置片刻后过滤,
⑤对滤液蒸馏纯化,收集221~224℃馏分,得水杨酸甲酯6.1g。
⑥其它量不变,改用2mL浓H2SO4重复上述操作,得水杨酸甲酯5.5g.
回答下列问题:
(1)甲中所用三颈烧瓶应选用 ,
| A.100mL | B.150mL | C.250mL | D.500mL |
(2)整个实验两次用到蒸馏装置,第一次用蒸馏装置的目的是: 。
(3)步骤③中所用到的玻璃仪器的名称是 ;
(4)本实验甲醇要过量,其目的是 ,
(5)步骤③要进行两次水洗,如果没有进行第二次水洗,可能的后果是 。
(6)浓H2SO4的用量为3mL时,水杨酸甲酯的产率是 ,
(7)该实验中,浓硫酸主要表现了 性质。
【改编】研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
| 离子 |
离子半径(pm) |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
74 |
7.6 |
9.7 |
| Fe3+ |
64 |
2.7 |
3.7 |
| Al3+ |
50 |
3.8 |
4.7 |
| Mn2+ |
80 |
8.3 |
9.8 |
| Pb2+ |
121 |
8.0 |
8.8 |
| Ca2+ |
99 |
- |
- |

请回答下列问题:
(1)写出浸出过程中生成Mn2+反应的离子方程式 。
(2)氧化过程中主要反应的离子方程式为: ,氧化的目的为: 。
(3)在氧化后的液体中加入 ,用于调节pH值,应调节pH的范围为 ,除去的主要离子为: ,吸附步骤除去的主要离子为 。
(4)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol·L—1CaCl2溶液与2.00×10—2mol·L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是 。
硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”。它易溶于水,难溶于乙醇,加热易分解。工业上常用亚硫酸钠法、硫化碱法等制备。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节螺旋夹,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电磁搅拌器搅动。
②至析出的硫不再消失,控制溶液的pH接近7时,停止通入SO2气体。
③抽滤所得的滤液,转移至蒸发皿中,水浴加热浓缩,直到溶液表面出现晶膜。
④冷却结晶、抽滤、洗涤。
⑤将晶体放入烘箱中,在40~45℃左右干燥50~60min,称量。
请回答以下问题:
(l)仪器a的名称是 ;
(2)步骤②中若控制pH值小于7,则产率会下降,请用离子方程式解释原因: 。
(3)步骤③中不能将溶液蒸发至干的原因是 ;晶膜通常在溶液表面出现的原因是 。
(4)步骤④中洗涤硫代硫酸钠晶体所用试剂的结构式是 。
(5)为检验制得的产品的纯度,该实验小组称取5,0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.0lmol·L-1 KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O =2I-+S4O
=2I-+S4O ,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表:
,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表:
| 实验序号 |
1 |
2 |
3 |
| Na2S2O3溶液体积(mL) |
19.98 |
20.02 |
21.18 |
则该产品的纯度是____ ,间接碘量法滴定过程中可能造成实验结果偏低的是____ 。
A.滴定管末用Na2S2O3溶液润洗
B.滴定终点时仰视读数
C.锥形瓶用蒸馏水润洗
D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡
硫酸锌被广泛应用于工农业生产和医药领域.工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的一种流程如下:
(1)步骤Ⅰ包括酸浸和过滤两个操作。
①酸浸时,需不断通入高温水蒸气的目的是 。
②过滤时为防堵塞,过滤装置需常用NaOH溶液清洗,其清洗原理是 (用化学方程式表示)。
(2)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为 。
(3)步骤Ⅲ所得滤渣Z的主要成分是 。
(4)取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如下图所示。
①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是 。
②在图中C点,680 ℃时所得固体的化学式为 (填字母序号)。
a.ZnO b.ZnSO4c.ZnSO4·H2O d.Zn3O(SO4)2
d.Zn3O(SO4)2
【改编】二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题。
(1)实验室可由多种途径制取SO2。
途径I:Na2SO3固体与较浓的硫酸(约70%)反应制取;
途径II:铜与浓硫酸加热制取。
写出途径II的化学反应方程式: 。
若将Cu改为Zn,发现除得到SO2外还有得到一种气体,该气体可能为 。写出生成该气体的离子方程式 。
(2)如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。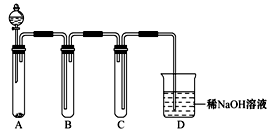
已知:2 KMnO4+16HCl(浓)= 2KCl+2MnCl2+5Cl2↑+8H2O。:
C的作用为: ;
D的作用为: ;
如要得到较为纯净的氯气可怎么改进该装置: 。
(3)某同学设计用如下装置探究二氧化硫、氯气的化学性质。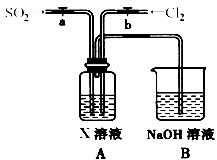
通过控制弹簧夹a、b,向装置A中分别通入不同气体,请完成如下问题:
①若要证明SO2的漂白性,X为 ,操作为 ,现象为 。
②若关闭a,打开b,若X为紫色石蕊试液,则A中的现象为: ,原因是 。
③若同时打开a、b,且通入的气体体积比为1:1,若X为紫色石蕊试液,则A中的现象为 ,与②现象不同的原因是 (书写相应的化学方程式)。