水杨酸甲酯对多种细菌的繁殖和黏附有抑制作用,也是安全、有效的植物生长调节剂。实验室制备水杨酸甲酯装置示意图和有关数据如下:

反应原理:
实验步骤:
①在干燥的三颈烧瓶中入7.0g水杨酸、30mL(0.64moL)甲醇、3mL浓H2SO4和2~3片碎瓷片,在85~95 ℃下加热回流(如图甲);
②1.5h后将回流装置改为蒸馏装置,水浴加热(如图乙);
③余下的反应液冷却至室温,依次用水、碳酸钠溶液和水洗涤,后再分离(如图丙);
④分出的产物加入少量无水CaCl2固体,静置片刻后过滤,
⑤对滤液蒸馏纯化,收集221~224℃馏分,得水杨酸甲酯6.1g。
⑥其它量不变,改用2mL浓H2SO4重复上述操作,得水杨酸甲酯5.5g.
回答下列问题:
(1)甲中所用三颈烧瓶应选用 ,
| A.100mL | B.150mL | C.250mL | D.500mL |
(2)整个实验两次用到蒸馏装置,第一次用蒸馏装置的目的是: 。
(3)步骤③中所用到的玻璃仪器的名称是 ;
(4)本实验甲醇要过量,其目的是 ,
(5)步骤③要进行两次水洗,如果没有进行第二次水洗,可能的后果是 。
(6)浓H2SO4的用量为3mL时,水杨酸甲酯的产率是 ,
(7)该实验中,浓硫酸主要表现了 性质。
V mL Al2(SO4)3溶液中含Al3+bg,溶液中SO42-的物质的量浓度是_____________mol·L-1
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选择适当的化学试剂和实验用品,用下图中的实验装置进行试验,证明过氧化钠可作供氧剂。
①A是制取CO2的装置。
②B中盛饱和NaHCO3溶液,其作用是_____________________________。
③D中盛放的试剂是____________,其目的是__________________。
④C中发生的主要反应方程式是_____________________________。
某化学研究性学习小组以海带为原料制取了少量碘水。现用四氯化碳从碘水中萃取碘并用分液漏斗分离两种溶液。其实验操作可分解为如下几步:
| A.把盛有溶液的分液漏斗放在铁架台的铁圈中; |
| B.把50 mL碘水和15 mL四氯化碳加入分液漏斗中,并盖好玻璃塞; |
| C.检查分液漏斗活塞和上口的玻璃塞是否漏液; |
| D.倒转分液漏斗,振荡,并不时旋开活塞放气,最后关闭活塞,分液漏斗放正; |
(E)旋开活塞,用烧杯承接溶液;
(F)从分液漏斗上口倒出上层水溶液;
(G)将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
(H)静置、分层;
就此实验,完成下列填空:
(1)正确操作步骤的顺序是:(用上述各操作的编号字母填写)→→→A→H→G→E→F。
(2)能选用四氯化碳从碘水中萃取碘的原因是;_________________________。
(3)已知碘在酒精中的溶解度比在水中大的多,能不能用酒精来萃取碘水中的碘_________(填“能”或“不能”),其理由是。
(4)上述G步骤的操作目的是__________________
下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: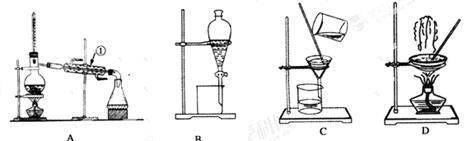
(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置________________。
(2)从碘水中分离出I2,应该选择装置________,该分离方法的名称为_________。
(3)装置A中①的名称是________,进水的方向是从________口进水。装置B在分液时为使液体顺利下滴,应进行的具体操作是____________________________________。
实验室制乙烯,常常因为温度过高而使乙醇与浓硫酸反应生成少量的二氧化碳,有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。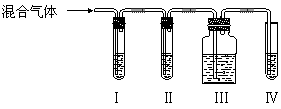
(1)写出实验室制取乙烯的化学方程式________________________________
(2)Ⅰ、Ⅱ、Ⅲ、Ⅳ装置中可盛放的试剂是:(将下列有关试剂的序号填入空格内)
Ⅰ:、Ⅱ:、Ⅲ:、Ⅳ:。
| A.品红溶液 | B.NaOH溶液 | C.浓硫酸 | D.溴水 |
(3)能说明二氧硫存在的现象是。
(4)使用装置(Ⅱ)的目的是。
(5)使用装置(Ⅲ)的目的是。
(6)确证含乙烯的现象。
(7)进行下列实验时,都要使用温度计,回答下列问题:
制取乙烯时,温度计水银球部位应放在。
石油分馏时,温度计水银球部位应放在。